如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
| A.在①中Cu棒为阳极;在②中Cu棒为负极 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑; ②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是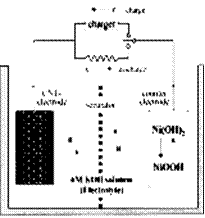
| A.储存H2的碳纳米管作电池正极 |
| B.放电时负极附近pH减小 |
| C.放电时电池正极的电极反应为: NiO(OH)+H2O+e-=Ni(OH)2 +OH- |
| D.放电时,电池反应为2H2+O2→2H2O |
下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液②用盐析法分离出皂化反应产生的高级脂肪酸钠③用蒸馏法分离C2H5OH与H2O的混合物④用分液法分离H2O和C2H5Br的混合物。你认为上述方法()
| A.只有①不正确 | B.②③不正确 |
| C.只有③④正确 | D.全部正确 |
下面有三则关于“CO2”的消息:
(1)1999年美国《科学》杂志报道:在40Gpa的高压下,用激光器加热到1800K,人们成功地制得了原子晶体干冰。
(2)CCTV《科技博览》报道,2004年3月中科院首创用CO2合成降解塑料聚二氧化碳。
(3)超临界流体是温度和压力同时高于临界值的流体,也即压缩到具有接近液体密度的气体,是物质介于气态和液态之间的一种新的状态。
针对以上消息,下列推断中正确的是
①原子晶体干冰有很高的熔点、沸点;②原子晶体干冰易汽化,可用作致冷剂;③原子晶体干冰的硬度大,可用作耐磨材料;④聚二氧化碳塑料是通过加聚反应得到的;⑤聚二氧化碳塑料与干冰互为同素异形体;⑥聚二氧化碳塑料都属于纯净物;⑦聚二氧化碳塑料的使用会产生白色污染;⑧超临界二氧化碳与CO2的物理性质不同,但化学性质相同;⑨超临界二氧化碳可能是一种原子晶体;⑩超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
| A.②③④⑨⑩ | B.②③④⑤⑥⑧⑩ | C.①③④⑧⑩ | D.③④⑦⑧⑨ |
由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
| A.水分子的化学性质改变 | B.水分子中氢氧键缩短 |
| C.水分子间的作用力减小 | D.水分子间结构、物理性质改变 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法一定正确的是
| A.60g SiO2晶体中,含有2×6.02×1023个Si-O键 |
| B.18g D2O(重水)完全电解,转移2×6.02×1023个电子 |
| C.720g C60晶体含有6.02×1023个如图中晶胞单元 |
| D.14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023个 |