有A、B、C、D、E五种短周期元素,已知相邻的A、 B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2。E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
(1)五种元素的名称:A______,B______, C______,D______,E______。
(2)B、C、D元素的原子半径由大到小的顺序为__________________________,
它们的最高价氧化物对应水化物的酸性强弱顺序为_________________________。
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式 ____。
(4)A与E形成的化合物的化学式是 ____,它的性质决定了它在物质的分类中应属于 ____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是 ____,有关反应的离子方程式为 ____。
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g) H = -190 kJ·mol-1
H = -190 kJ·mol-1
该热化学反应方程式的意义是 ____________________________________。
(2) 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知: CO (g)+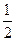 O2 (g) = CO2 (g)
O2 (g) = CO2 (g) H = -283.0 kJ·mol-1
H = -283.0 kJ·mol-1
S (g)+ O2 (g) = SO2 (g) H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1
此反应的热化学方程式是__________________________________________________。
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。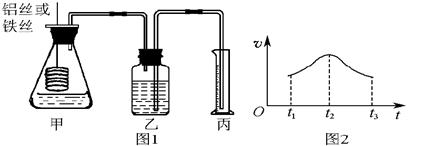
(1)检查图1所示装置气密性的方法是_______________________________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量_______________________________________________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是________________________________。
某体系中存在如下反应:
① H2S+4H2O-8e → SO42-+10H+② 2IO3-+12 H++10e → I2+6H2O
(1)反应①中H2S做_______剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成g 碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________
(4)由上述反应可推知。
a.氧化性:K2SO4> KIO3 b.酸性:H2S> H2SO4
c.还原性: H2S > I2 d.反应过程中溶液的酸性逐渐减弱
元素化合物的知识是中学化学的重要知识,请结合有关知识回答下列问题:
(1)NaHCO3是发酵粉的主要成分之一,主要是利用其受热易分解的性质,请写出该反应的化学方程式:__________________________
(2)实验室的浓硝酸需用棕色瓶储存并置于冷暗处其原因是(用化学方程式说明)
(3)治疗胃酸过多常服用氢氧化铝,其药理是:
(用离子方程式说明)
(4)实验室制氯气的离子方程式为:______________________,若在标准状况下,产生11.2升氯气,则被氧化的HCl的物质的量为mol。
(5)写出铝粉和氧化铁发生铝热反应的化学方程式,铝热反应常用于生产上,请你举出一例用途。
某体系中存在如下反应:
① H2S+4H2O-8e → SO42-+10H+② 2IO3-+12 H++10e → I2+6H2O
(1)反应①中H2S做_______剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成g 碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________
(4)由上述反应可推知。
a.氧化性:K2SO4> KIO3 b.酸性:H2S> H2SO4
c.还原性: H2S > I2 d.反应过程中溶液的酸性逐渐减弱