元素化合物的知识是中学化学的重要知识,请结合有关知识回答下列问题:
(1)NaHCO3是发酵粉的主要成分之一,主要是利用其受热易分解的性质,请写出该反应的化学方程式:__________________________
(2)实验室的浓硝酸需用棕色瓶储存并置于冷暗处其原因是(用化学方程式说明)
(3)治疗胃酸过多常服用氢氧化铝,其药理是:
(用离子方程式说明)
(4)实验室制氯气的离子方程式为:______________________ ,若在标准状况下,产生11.2升氯气,则被氧化的HCl的物质的量为 mol。
(5)写出铝粉和氧化铁发生铝热反应的化学方程式 ,铝热反应常用于生产上,请你举出一例用途 。
A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图。
(2)写出化合物E2F2的电子式,化合物ABC的结构式。
(3)根据题目要求完成以下填空:
BF32-中心原子杂化方式;D3中心原子杂化方式;
FD42-微粒中的键角;FD3分子的立体构型。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有、(要求写一种分子和一种离子)。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。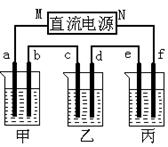
接通电源,经过一段时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系如图。
据此回答下列问题:
(1)M为电源的____极(填写“正”或“负”),甲、乙电解质分别为______、_____(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积:_____________。
(3)写出乙烧杯的电解池总反应方程式:_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入______克(填质量)的。(填写化学式)
(本题共14分)科研人员发现,一些化学反应在固体之间发生和在水溶液中发生,产物不同。铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。将CuCl2·2H2O晶体和NaOH固体混合研磨,生成物中有一黑色的固体A。A不溶于水,但可溶于稀硫酸生成蓝色溶液B。
58、A的化学式为;A不同于CuCl2和NaOH在溶液中反应所得产物的可能原因是。
59、在含0.02molB的溶液中加入适量氨水恰好完全反应,得到浅蓝色沉淀C和无色的溶液D;C溶于盐酸后,加入足量的BaCl2溶液,生成2.33g白色沉淀;无色的溶液D中加入足量的NaOH,加热收集到无色有刺激性气味的气体E。
①通过计算确定C的化学式为_____________。
②E是(填物质名称),E在标准状况下的体积为mL。
60、若向B中加过量氨水后再通入SO2至微酸性,最终得到白色沉淀F和无色的溶液。分析知,F是不含结晶水的复盐,其部分元素的质量分数为:Cu 39.31%、S 19.84%、N 8.67%。
①通过计算确定F的化学式_____________。
②写出由B生成F的化学方程式_____________。
61、将F与中等浓度的硫酸混合加热,会放出无色有刺激性气味的气体,析出紫红色沉淀,同时得到蓝色的溶液。写出该反应的化学方程式_____________。
(本题共12分)胃复安是镇吐药及消化功能异常治疗药,其合成路线如下图:
已知:(1)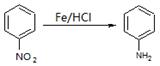
(2)R-NH2+(CH3CO)2O R-NHCOCH3+CH3COOH
R-NHCOCH3+CH3COOH
请回答下列问题:
53、写出反应类型:反应①______________,反应③______________。
54、写出结构简式:M____________________________ E____________________________。
55、写出第⑥步除F外另一种产物的结构简式_______________________________。
56、B的含苯环结构的同分异构体G和H都能使FeCl3溶液变紫色,其中G只含3种不同化学环境的氢原子;H具有α—氨基酸的结构。
(1)写出2种G的同分异构体的结构简式________________________________。
(2)写出H(任一种)通过肽键连接形成高分子化合物的化学方程式________________________。
57、已知: ,参照上述合成路线中的有关信息,写出由对甲苯酚为原料合成
,参照上述合成路线中的有关信息,写出由对甲苯酚为原料合成 的合成流程图(其它试剂自选)。
的合成流程图(其它试剂自选)。
(本题共10分)有机物(C6H12)的两种异构体A和B和其他一些有机物之间有如图所示的转化关系。其中G的一氯取代物只有两种,A的分子结构中有3个甲基,B转变为F时只有一种产物。
请填写下列空白:
48、上述转化过程中,属于加成反应的是____________(填序号)。
49、有机物G的名称为_________________________。
50、有机物A和C12H22O3结构简式分别为:A_________________、C12H22O3_________________。
51、写出②、③、两步反应的化学方程式:
②_______________________________________________________________________;
③_______________________________________________________________________。
52、A在一定条件下发生加聚反应的化学方程式:__________________________________。