铜在工农业生产中有着广泛的用途。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H= kJ•mol-1.
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”).
(2)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(3)氢化亚铜是一种红色固体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
①该反应还原剂是 (写化学式).
②该反应每转移3mol电子,生成CuH的物质的量为 mol.
(4)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:

①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol· ,则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。
,则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。
(KSP[Fe(OH)3]=1.0×10—38、KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2→O2。
(1)该物质H2O2在反应中表现出(填写编号)。
a、氧化性 b、还原性 c、氧化性和还原性 d、均不正确
(2)若反应转移了5.418×1023个电子,则产生的气体在标准状况下的体积是________L。
(3)将 氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目: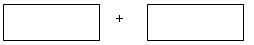
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O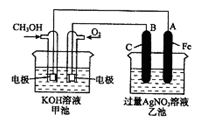
(1)请回答下列电极的名称:
通入CH3OH的电极名称是,
B(石墨)电极的名称是。
(2)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(3)乙池中反应的化学方程式为。
在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) 3C(g) +
3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
(1)写出该反应平衡常数的表达式,
2分钟内B 的平均反应速度为
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,
则正反应为(填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1L,反应达到平衡时C的浓度为mol·L-1,
平衡常数(填“增大”、“减小”或“不变”)。
下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题: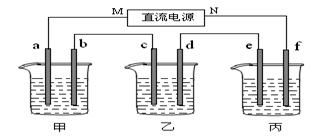
 (1)电源的N端为极;
(1)电源的N端为极;
(2)电极b上发生的电极反应为;
(3)电极c上生成的气体在标准状态下的体积:;
(4)甲溶液的氢氧根离子浓度为(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为,e电极的材料是:,f电极的电极反应式为。
(共18分)I写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II.(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应; 如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。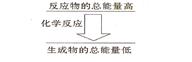
(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答: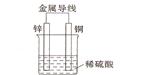
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。