海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是___________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:____。
④C中液体产物颜色为________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________。
钠、氯及其化合物有如下转化关系,请按要求填空: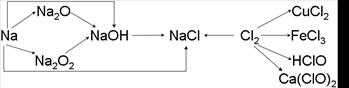
(1)金属钠的密度比水,实验室中金属钠通常保存在中。金属钠投入水中,剧烈反应,反应的化学方程式为。
(2)Na2O2 是色的固体,Na2O2 可用于呼吸面具作氧气的来源,有关反应的化学方程式为。
(3)通常情况下,为了防止Cl2污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为。若NaOH溶液吸收了33.6L(标况) Cl2反应转移的电子的数目为。
(4)将新制氯水滴入AgNO3溶液中,观察到现象,原因是。将红色布条投到新制氯水中,观察到红色布条退色,原因是。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
HX +  (X为卤素原子)
(X为卤素原子)
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是________ _______________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分
子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
_____________________________,_______________________________。
(16分)已知一个碳原子连两个—OH的结构不稳定,会很快脱去一分子水,其变化如下: →
→ +H2O
+H2O
下图中B和 、
、 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
(1)A的化学名称为___ _
(2)第④步的化学方程式为__________,该反应类型为_____;
(3)第⑦步的化学方程式为__________,该反应类型为_____;
(4)E的结构简式为______;
(5)符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢的C的同分异构体的结构
简式分别是、、。
(每空2分,共14分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是_____,化合价没有发生变化的反应物是______。
(2)该反应中,发生还原反应的过程是(填化学式)___________→____________ 。
(3)上述反应中, 1 mol氧化剂在反应中______(填“得到”或“失去”) ____ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个化学性质:。
(每空3分,共6分)
(1)在标准状况下,气体A的密度为1.25g/L,气体B的相对分子质量为42,A和B的混合气体在相同状况下对H2的相对密度为16.8,则混合气体中A和B的体积比为。
(2)把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的物质的量浓度为。