反应A(g)  B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题: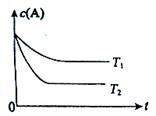
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是,还原剂是。每生成1molNa2FeO4,转移mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。。
A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
试回答:
(1)若X是强氧化性单质,则A不可能是(填字母)。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为;在贮存C溶液时应加入少量X,理由是(用必要的文字和离子方程式表示)。
(3)若A、B、C为含有金属元素的无机化合物,X为强酸或强碱,A溶液与C溶液反应生成B。反应①的离子方程式可能为或。
金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体):
(1)在灼烧铝矿时发生化学反应: ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为________。
(3)写出步骤②中发生反应的离子方程式_________________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化铝,同时检验该反应的氧化产物,根据要求回答下列问题。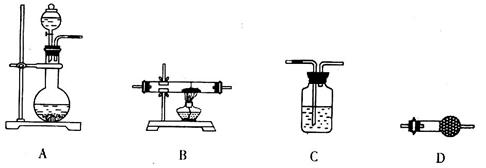
①若两次使用到C装置,则装置D中所盛的药品是________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后______→______→______→______(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):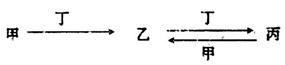
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示: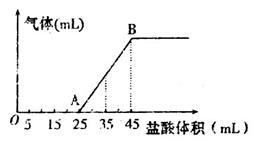
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
(1)W元素在周期表的位置为______________。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该元素是_________(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为___________(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点
b.测等浓度相应氯化物水溶液的pH
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(6)Z单质和Mg组成的混合物是一种常见的焰火材料,某化学兴趣小组设计了如下图所示的实验方案,测定该混合物中Z的质量分数。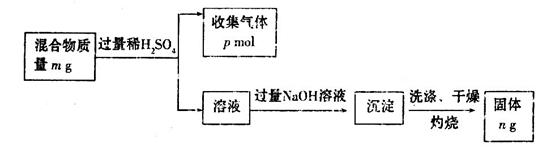
能确定混合物中Z的质量分数的数据组有_________(填代号)。
a. b.
b. c.
c.