某些化学反应可用下式表示:A + B C + D + H2O,请回答下列问题:
(1)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式: 。
(2)若A为水垢的主要成分之一,B是日常生活常见有机物,写出该反应的化学方程式: 。
(3)若A为黑色固体,C是黄绿色的单质气体,写出该反应的离子方程式: 。
(4)若A为亮红色单质,B为第二周期某种元素的最高价氧化物的水化物,A、B、C、D中只有D是气体,若D无色,写出该反应的化学方程式: 。
(5)若C、D均为气体且都能使澄清石灰水变浑浊,则只用 或 (任写两种试剂的名称)就可以鉴别C、D两种气体。
(11分)电化学在工业生产中有广泛应用。
(1)右图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,
C(I)、C(II)为多孔石墨电极。
①电解NaCl饱和溶液的化学方程式为。
②接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。则电极C(I)是(填“阳”或“阴”)极;检验C(II)电极反应所得气体产物的方法和现象是。
③一段时间后(玻璃管中液面未脱离电极),断开S1,则C(I)、C(II)两玻璃管内气体的体积V(I)、V(II)的关系是:V(I)V(II)(填“>”、 “=”或 “<”) 。断开S1接通S2,电流表的指针发生偏转,此时电极C(II)是(填“正”或“负”)极;C(I)的电极反应是:。
(2)若用此装置精炼粗铜,断开S2,接通S1,电解液选用CuSO4溶液,当电路中有0.04 mol电子通过时,阴极增重g。
(7分)据报道,摩托罗拉公司开发了一种以甲醇为原料,以 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)放电时:负极的电极反应式为____ _____。
(2)充电时:①原电池的负极与电源_________极相连。
②阳极的电极反应为__________________。
(3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗 _________L(标准状况下)。
_________L(标准状况下)。
(7分)在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答下列问题:
(1)该溶液中HSO3-的电离程度______(填“大于”、“小于”或“等于”)HSO3-的水解程度。
(2)溶液中Na+、HSO3-、H+、OH-、SO32-等离子的浓度由大到小的顺序为。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是。其原因是(以离子方程式及简要文字说明)。
(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4KJ/mol" ,据此回答以下问题:
2NH3(g) △H=" -92.4KJ/mol" ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。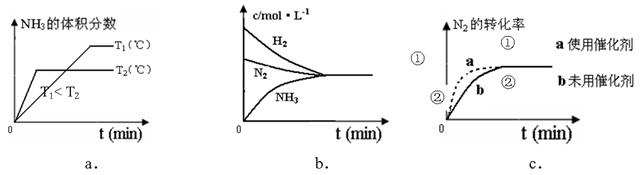
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(8分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为。
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是,产生该现象的原因是(用离子方程式或文字表示)。