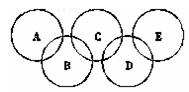
奥运五环“象征五大洲的团结,全世界的运动员以公正、坦率的比赛和友好的精神,在奥运会上相见”。右下图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素。A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3∶4。根据以上信息回答下列问题:
(1)A用于工业制取硝酸所发生反应的化学方程式 。
(2)D的化学式是 ,E分子中含有 键和 键。
(3)B的水溶液呈弱酸性,其电离方程式可表示为 ,B在实验室中可以用于制取某种常见气体,其反应的化学方程式为 。
(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为
。
(5)用化学方程式表示C的另一种用途 。
按下图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为,B池为。
(2)锌极为极,电极反应式为;铜极为极,电极反应式为;石墨棒C1为极,电极反应式为;石墨棒C2附近发生的实验现象为,反应结束后,B池溶液的pH值。(增大、减小、不变,忽略气体溶于水) 。
(3)当C2极析出224 mL气体(标准状况下),锌的质量(增加或减少)g。
推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)写出过氧化氢的电子式。
(2)该反应的热化学方程式为。
1mol肼完全反应转移电子数。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(4)又已知H2O(l)==H2O(g);△H = +44kJ∙mol-1,由16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30min |
(1)写出上述实验中发生反应的化学方程式:,该反应是反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与有关。
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析: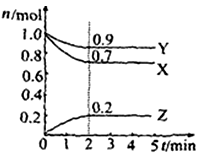
(1)该反应的化学方程式为:。
(2)反应开始至2min,用Z表示的平均反应速率为:。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度B.加入催化剂C.增大容器体积
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
(1)A为池,(填原电池、或电解池),其中的Ag极为极,发生反应(填“氧化”或“还原”)。
(2)B装置中的电极b极为极,电极反应式为,总反应的化学方程式为。经过一段时间后,B装置中溶液的碱性(填“增强”、“减弱”或“不变”)
(3)若工作一段时间后,当Zn片质量减少3.25g时,a极逸出的气体在标准状况下的体积为L。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的电子式是:。
(3)最高价氧化物是两性氧化物的元素是;写出它的氧化物与氢氧化钠反应的离子方程式。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:。
(5) ②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因。
(6) 用结构式表示元素①与③形成的化合物 ,该化合物在固体时俗称,属于晶体,指出它的一种用途。