工业制取漂白粉的化学方程式是 。久置的氯水会变为无色,发生反应的方程式是 ,该反应中若转移0.2mol电子,则产生标准状况的气体________________ L。
(6分)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)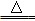 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式___________________________________________。
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应,Cl2是________(同上)产物。
(3)当0.1 mol MnO2参加反应时,转移电子数为________,被氧化的HCl为________ mol。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 周期族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
⑤ |
||||
| 3 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)非金属性最强的是(填元素名称)、化学性质最不活泼的是__________。
(2)⑤的气态氢化物稳定性比⑨的气态氢化物________。(填“强”、“弱”或“相同”)
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________。(填化学式)
(4)可作为补钙产品成分之一的化学物质是_________;
A.CaO B.Ca(OH)2 C.CaCO3 D.Ca
(5)⑧的原子结构示意图为_________________,其气态低价氧化物通入___________溶液中,能使该溶液褪色,说明该氧化物具有 性。
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被MnO2催化分解,写出反应的化学方程式 _______________________________________。
(7)我省有的地区都使用天然气作为燃料。天然气主要成分的结构式为,该物质中氢元素的质量分数为。
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要,形成化学键要。已知拆开1 mol H-H键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要(填“放出”或“吸收”)kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
如右图装置,烧杯中盛有饱和食盐水,X、Y是两块石墨电极,两电极通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题: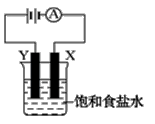
①该装置最主要的能量转化为_________________
②在X电极附近溶液中可观察到的现象是X电极上发生_______反应(填“氧化”或“还原”),电极反应式为_____________________。
③检验Y电极上产物的方法是。
④装置的总反应化学方程式是。
分子式为C2H6O的化合物A具有如下性质: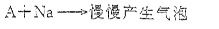
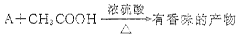
(1)根据上述信息,对该化合物可作出的判断是。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作。
(3)A与钠反应的化学方程式:。
(4)写出A与CH3COOH反应产生有香味产物的化学方程式:。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 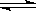 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)达平衡的时间是,理由是。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。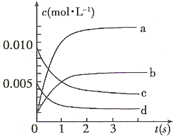
(3)能说明该反应已达到平衡状态的是。
a.v(NO2) = 2v(O2) b.容器内各物质的浓度保持不变
c.v逆(NO) = 2v正(O2)d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂