某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 ,固体B是 。(填化学式)
(3)加入试剂a所发生的化学反应方程式为: 。
加入试剂b所发生的化学反应方程式为: 。
(4)该方案能否达到实验目的: 。若不能,应如何改进(若能,此问不用回答) 。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 (填“A”、“A1”、“B”、“C”)的质量。
G是一种工业增塑剂,其合成的流程如下:
已知:(1)A侧链上有两种不同环境下的氢原子;(2)B是芳香烃
(1)A中含氧官能团的名称,F的分子式,
C→D的反应条件,B的结构简式。
(2)A1是与A含有相同官能团的同分异构体,同条件下也能制得B,写出A1生成B的化学方程式。
(3)写出D→E的化学方程式。
(4)F物质的消去产物H是一种药物中间体,关于H的下列叙述正确的是。
a.能发生取代、消去、氧化、加聚反应
b.将H加入溴水中,振荡后得到无色溶液
c.等物质的量H与F反应后,生成物可能的分子式C18H16O4
d.1mol H在一定条件下与H2反应,最多消耗H2 4mol
(5)E有多种同分异构体,符合下列条件的芳香族同分异构体共有种。
①既能与稀硫酸又能与NaOH溶液反应②能发生银镜反应
③分子中只有一个甲基
特戊酸是一种重要的化学试剂和化工原料, 工业上可用异丁烯与一氧化碳和水蒸气或叔丁醇与甲酸反应制得。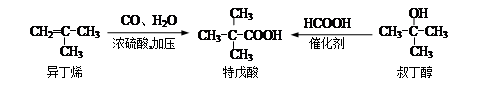
根据题意回答下列问题:
(1)用系统命名法命名特戊酸___________,异丁烯最简单的同系物的分子式是_________;甲酸分子中含有的能体现主要化学性质的官能团的名称是_______________。
(2)聚合度不大的聚异丁烯能给化妆品以极好而高贵的手感,写出异丁烯发生聚合反应的化学方程式:_____________________________________。
(3)异丁烯二聚物(二异丁烯)再与氢气加成可制得优质汽油,二聚是一分子甲基上的碳-氢键断裂后与另一异丁烯分子中的双键发生加成反应,写出二聚加成产物可能的结构简式:_________________________________________。
(4)叔丁醇同类别的同分异构体(含叔丁醇)有________种(填写数字),写出叔丁醇与甲酸发生酯化反应的化学方程式: _____________________________________________________。
(5)特戊酸稳定的同分异构体中的一个分子中不可能同时含有____(填写编号)。
a.2个-CHO b.1个–OH和1个-CHO
c.2个–OH d.1个-COO-和1个环
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| 活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
| 初始 |
2.030 |
0.100 |
0 |
0 |
| 平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为mol/(L·min);当活性炭消耗0.015mol时,反应的时间(填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理。
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目:。
(3)某厂废水中含1.00×10−3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入g FeSO4·7H2O。
化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式,该分子属
于(填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等