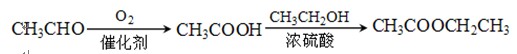直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) |
99:1 |
1:1 |
1:99 |
| pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图: 
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
【化学——选修3 物质结构基础】
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为,氧元素与氟元素能形成OF2分子,该分子的空间构型为。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为,1mol NO2+所含 键的数目为。
键的数目为。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由 此可判断该钙的氧化物的化学式为。
已知晶胞边长为540pm,则该氧化物的密度是g·cm-3
[化学——选修2化学与技术]
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:_________________________________________________;
②写出“联合制碱法”有关反应的化学方程式___________________;
。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
①炼钢时,加入硅、锰和铝的目的是_______________________________。
②不锈钢含有的Cr元素是在炼钢过程的氧吹____(填“前”或“后”)加入。
③炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
(17分) 氯碱厂电解饱和食盐水制取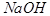 的工艺流程示意图如下:
的工艺流程示意图如下:
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_________________________________;与电源负极相连的电极附近,溶液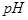 值___________。(选填:不变、升高或下降)
值___________。(选填:不变、升高或下降)
(2)工业食盐含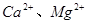 等杂质,精制过程发生反应的离子方程式为____________________________________________;
等杂质,精制过程发生反应的离子方程式为____________________________________________;
(3)如果粗盐中 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是________(选填a、b、c多选倒扣分)
,该钡试剂可以是________(选填a、b、c多选倒扣分)
a.  b.
b.  c.
c. 
(4)为有效除去 ,加入试剂的合理顺序为_____________(选填a、b、c多选倒扣分)
,加入试剂的合理顺序为_____________(选填a、b、c多选倒扣分)
a. 先加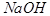 ,后加
,后加 ,再加钡试剂
,再加钡试剂
b. 先加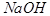 ,后加钡试剂,再加
,后加钡试剂,再加
c. 先加钡试剂,后加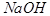 ,再加
,再加
(5)脱盐工序中利用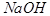 和
和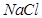 在溶解度上的差异,通过____________、冷却、______________(填写操作名称)除去
在溶解度上的差异,通过____________、冷却、______________(填写操作名称)除去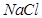 。
。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止 与
与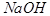 反应;采用无隔膜电解冷的食盐水时,
反应;采用无隔膜电解冷的食盐水时, 与
与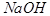 充分接触,产物仅是
充分接触,产物仅是 和
和 ,相应的化学方程式为_____________________。
,相应的化学方程式为_____________________。
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识同答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为,反应中消耗1mol的MnO—4时转移电子数为。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是mol。
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474g KMnO4样品溶解酸化后,用0.100mol/L标准Na2S2O3溶液进行滴定,滴定至终点的现象是。实验中,滴定至终点时消耗Na2S2O3溶液12.00mL,则该样品中KMnO4的纯度是。(有关离子方程式为:8MnO—4+5S2O2—3+14H+=8Mn2++10SO2—4+7H2O
(4)Mg—H2O2酸性电池采用海水作龟解质溶液(加入一定量的稀硫酸),该电池的负极材料是
___,正极的反应式为。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____,又变为棕黄色的原因是。
[化学——有机化学基础]
某课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。

请回答:
(1)产品的摩尔质量为_____________________。
(2)在①~⑥的反应中属于取代反应的有_______________________。
(3)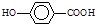 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)。
(4) 的同分异构体很多,其中符合下列条件有______种。
的同分异构体很多,其中符合下列条件有______种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为。
(5)高分子化合物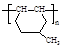 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: