有如下两个反应: A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A B (填“能”或“不能”)不能设计成原电池的原因是
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是
②写出负极的电极反应式
③若导线上转移电子0.2mol,则负极质量变化是
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应反应
(1)合成氨反应反应
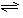 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。 (2)
(2)
 则反应
的
=
。
则反应
的
=
。 (3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
(3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
 (4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
(4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
四川汶川盛产品质优良的甜樱桃。甜樱桃中含有一种羟基酸(用
表示),
的碳链结构无支链,化学式为
;1.34 g
与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。
在一定条件下可发生如下转化:



 其中,
、
、
、
分别代表一种直链有机物,它们的碳原子数相等。
的化学式为
(转化过程中生成的其它产物略去)。
其中,
、
、
、
分别代表一种直链有机物,它们的碳原子数相等。
的化学式为
(转化过程中生成的其它产物略去)。 已知:
已知:

的合成方法如下:
①


②
其中,
、
、
分别代表一种有机物。 请回答下列问题:
请回答下列问题:
 (1)
的结构简式是。
(1)
的结构简式是。 (2)
生成
的化学方程式是。
(2)
生成
的化学方程式是。
 (3)
与乙醇之间发生分子间脱水,可能生成的有机物共有种。
(3)
与乙醇之间发生分子间脱水,可能生成的有机物共有种。 (4)
的结构简式是。
(4)
的结构简式是。
 (5)写出
与水反应生成
和
的化学方程式:。
(5)写出
与水反应生成
和
的化学方程式:。
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(
)是新型锂离子电池的首选电极材料,它的制备方法如下:
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(
)是新型锂离子电池的首选电极材料,它的制备方法如下: 方法一:将碳酸锂、乙酸亚铁[
]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法一:将碳酸锂、乙酸亚铁[
]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用
表示)的结构简式如下:
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用
表示)的结构简式如下:

 请回答下列问题:
请回答下列问题: (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。 (2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、 、(填化学式)生成。
、(填化学式)生成。 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。 (4)写出M与足量氧化钠溶液反应的化学方程式:
(4)写出M与足量氧化钠溶液反应的化学方程式: 。
。 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为(用
表示)。 (2)负极反应式为。
(2)负极反应式为。 (3)电极表面镀铂粉的原因为。
(3)电极表面镀铂粉的原因为。
 (4)该电池工作时,
和
连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下
(4)该电池工作时,
和
连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下 Ⅰ.
Ⅰ.
 Ⅱ.
↑
Ⅱ.
↑ ①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是。
①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是。 ②已知
固体密度为0.82
。用锂吸收224
(标准状况)
,生成的
体积与被吸收的
体积比为。
②已知
固体密度为0.82
。用锂吸收224
(标准状况)
,生成的
体积与被吸收的
体积比为。 ③由②生成的
与
作用,放出的
用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
。
③由②生成的
与
作用,放出的
用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
。
超音速飞机在平流层飞行时,尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
和
转变成
和
,化学方程式如下:
 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的
和
浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的
和
浓度如表:


 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响): (1)在上述条件下反应能够自发进行,则反应的
0(填写">"、"<"、"=")。
(1)在上述条件下反应能够自发进行,则反应的
0(填写">"、"<"、"=")。 (2)前2
内的平均反应速率
=。
(2)前2
内的平均反应速率
=。 (3)在该温度下,反应的平衡常数
=。
(3)在该温度下,反应的平衡常数
=。 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高
转化率的是。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高
转化率的是。
| A. |
选用更有效的催化剂 |
| B. |
升高反应体系的温度 |
| C. |
降低反应体系的温度 |
| D. |
缩小容器的体积 |

 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中
浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中
浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。