(6分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下图所示:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为 _________________(只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、天平、玻璃棒、烧杯外还有______________________(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,开始时左边电极气泡比较多右边电极气泡比较少,原因是_________________。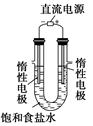
向盛有少量苯酚晶体的试管加入2ml蒸馏水,振荡试管,观察到的现象为,向试管中逐滴加入5%的NaOH溶液并振荡试管,现象,反应的化学方程式为
再加入稀盐酸,现象为
化学反应方程式为。
向盛有少量苯酚稀溶液的试管逐滴加入饱和溴水,观察到的现象为
化学方程式为:
这个实验很灵敏,可用于苯酚的定性检验和定量测定。
(7分)根据要求回答下列问题
(1)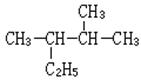 ________________________________(写名称)
________________________________(写名称)
(2)2-甲基-2-戊烯(写结构简式)
(3)键线式 表示的分子式。
表示的分子式。
(4)按官能团的不同,对有机物进行分类,请指出下列有机物的种类,填在横线上。
CH3CH2CH2Br __________;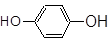 ___________;
___________; ________________;
________________;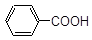 ________________;
________________;
某元素的一种同位素 ,其氯化物化学式为XCl2,取该氯化物1.11g
,其氯化物化学式为XCl2,取该氯化物1.11g
溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内质子数与中子数相同,则:
(1)通过计算求得A值(约等于相对原子质量)为;
(2)X元素在周期表中的位置;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为.
中学化学中有很多物质可以实现下图中物质之间的转化,其中反应条件和部分反应的产物已略去,液体B和C可能是单一溶质的溶液,也可能是纯净物。
(1)若A是一种紫红色金属,气体D能使品红溶液褪色,加热时又恢复原色。写出A与B反应的化学方程式。
(2)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色,则A与B溶液反应的离子方程式,
写出红棕色气体与水反应的化学方程式。
(3)若A是黑色固体单质,D是两种气体的混合物,其中有一种气体能使澄清石灰水变浑浊,则A与B溶液反应的化学方程式为。
(4)如果气体D和溶液B都能便湿润的红色石蕊试纸变蓝,则该反应的离子方程式为。
A、B、C、D、E五种短周期元素。A元素所处的周期数、主族序数、原子序数均相等;B元素原子的半径是其所在主族中最小的,其最高价氧化物对应水化物的化学式为HBO3;C元素原子最外层上的电子数为内层电子数的2倍;元素D的二价阴离子与E的阳离子的核外电子排布相同;E元素的周期数比族序数多2。请回答:
(1) 写出元素的符号:A;B_______。
(2) 画出D离子的结构示意图__________,C在周期表的位置为;
(3) C的最高价氧化物的电子式是;E与D的单质在常温下反应的生成物电子式为,E与D按原子数1∶1化合而成的物质所含化学键类型为。
(4) A与D可形成三种电子总数为10的微粒,其中形成的分子结构式为,写出另二种微粒其中一种的化学式; A与D还可形成电子总数为18的微粒,该微粒的化学式为。