肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
⑴肼的结构式为: 。
⑵如图是一个电化学过程示意图。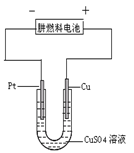
①铂片上发生的电极反应是 。
②假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)。
⑶肼——空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%—30%的 KOH溶液。肼——空气燃料电池放电时:负极的电极反应式是 。
工业上用铝土矿(主要成分为Al2O3,还有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(1)铝合金的用途是;(写出两种即可)
(2)写出加入盐酸后生成Al3+的离子方程式:
(3)写出固体A中加入烧碱后生成SiO32-的离子方程式:
(4)验证滤液B中含Fe3+,取少量滤液B并加入(填试剂名称)
查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为:。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属,②第2步属。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O
元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
(1)上表中与A属于同一周期的元素是(填元素名称),写出D离子结构示意图。
(2)D和B形成的化合物的化学式为。
写出A单质与水反应的离子方程式。
(3)对B、C的单质或化合物描述正确的是。
a.C元素的最高正价为+7b.常温、常压下C单质性质稳定
c.B的氧化物只有两种d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应d.置换反应
在①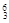 Li 、②
Li 、②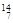 N 、③
N 、③ Na 、④
Na 、④ Mg 、⑤
Mg 、⑤ Li 、⑥
Li 、⑥ C 、⑦C60 、⑧石墨中,选择序号填空。
C 、⑦C60 、⑧石墨中,选择序号填空。
(1)和质量数相等,但不能互称同位素;
(2)和的中子数相等,但质子数不相等,所以不是同一种元素;
(3)和互为同素异形体。
工业上用铬铁矿(主要成分FeO·Cr2O3,杂质为SiO2、Al2O3等)
生产重铬酸钾(化学式K2Cr2O7,)的流程如下: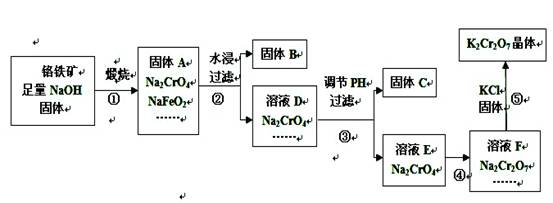
(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程
式为;
(3)固体C中含有2种物质,要先加入下列物质中的,然后才
能进行过滤分离。
A.氢氧化钠溶液B.稀氨水C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2 Cr2O7外,还含有的溶质
是;
(5)在上述流程中,有氧化还原反应发生的是第____步。
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4 mol·L-1,步骤⑤中加入固
体氯化钾,若使K+离子浓度达到4 mol·L-1(保持温度20℃),则溶液F中Cr2O72-离子的浓度最大为。