电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO- 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1 FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2 mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④ 该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。
取标准状况下2.24L某气态烃A置于密闭容器中,再通入足量的O2,用电火花引燃,燃烧产物的定量测定实验数据如下(图中的箭头表示气体的流向)。
试通过计算回答:
(1)烃A的分子式为。
(2)写出烃A的所有同分异构体的结构简式:。
(3)某有机物B仅含碳、氢、氧三种元素,其相对分子质量大于100,小于106。已知A、B分子中所含的氢原子数相同,则B的分子式为。
已知:乙醛在一定条件下可被氧气氧化为乙酸。A是石油裂解的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物之间的转化关系: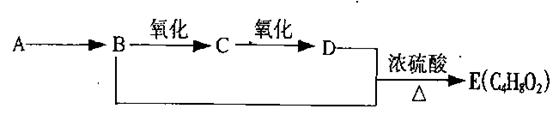
(1)A的结构简式为,可以作为水果的;
(2)B+D→E的反应类型为;
(3)写出B→C和B+D→E的两个化学反应方程式:
B→C:,
B+D→E:;
(4)除去E中所混有少量的D杂质,所需试剂的名称是:。
海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。
回答下列问题:
(1)请写出电解食盐水的离子方程式。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是:。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是;
③电解熔融氯化镁的化学方程式是;
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可用作镁蒸气的冷却剂是(填写代号)。
A.H2 B.Cl2 C.空气 D.O2
E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质:
①生成溴单质的化学反应的离子方程式是
②以下是对生产溴单质所用的气态氧化剂寻找货源的主凤想,其中合理的是
(填写代号)
A.以外地购买 B.在当地新建生产厂
C.从本厂生产烧碱外循环 D.从木厂生产镁单质处循环
③从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是。
在下图所示的转化关系中A、B、C、D、E、F、G、H、J均为常见物质。
已知B、D都是淡黄色固体,且A与D可的应生成离子化合物I,B与I的相对分子质量相同。请完成下列问题:
(1)写出下列物质的化学式:E,H;
(2)写出C的电子式:写出H2O2的电子式:;
(3)用电子式表示1的形成过程;
(4)写出B→C、E→F的化学反应方程式:B→C;E→F。
将下列物质进行分类:① H与
H与 H②O2与O3③乙醇与甲醚(CH3—O—CH3)④H2O与D2O⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3⑥C60与C35
H②O2与O3③乙醇与甲醚(CH3—O—CH3)④H2O与D2O⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3⑥C60与C35
(1)互为同位素的是(填编号、下同);
(2)互为同素异形体的是;
(3)互为同分异构体的是。