本题共有2小题,共15分,①命名下列有机物
②有人曾提出苯除了有平面正六边形结构外,还可能有空间立体结构,例如下面的Ⅰ式和Ⅱ式:
Ⅰ式: Ⅱ式:
Ⅱ式:
(1)若以Ⅰ式为主体,其一元取代物分子中2,4,6位上的氢原子性质相同,3,5位上的氢原子性质相同。则2,4,6-三氯硝基苯的结构简式为_____________。
(2)若Ⅱ式分子生成二氯苯,其可能有的同分异构体有6种,则其四氯苯的同分异构体有_______种。
A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。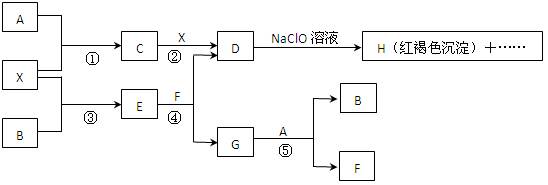
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤ 反应中肯定不属于氧化还原反应的是 (填编号);
反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置: ;
(4)请写出反应④和⑤的离子方程式:④ ,
⑤ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
。
现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)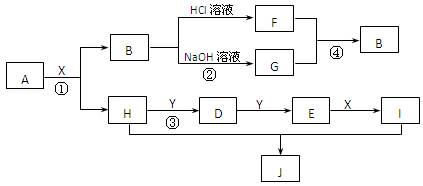
根据上述转化关系图回答:
(1)写出下列物质的化学式 X;J
(2)物质H的电子式:;
物质J属于哪种晶体类型: 。
。
(3)写出反应①的化学方程式;
写出反应④的离子方程式。
(共13分)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物完全燃烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的碳碳三键,核磁共振氢谱有三个峰,峰面积为6﹕1﹕1。
(1)A的分子式是;(2)A的结构简式是;
(3)下列物质中,一定条件能与A发生反应的是(填字母);
A.H2 B.Na C.KMnO4 D.Br2
(4)有机物B是A的同分异构体,1mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。则B的结构简式是。
(共15分)写出下列有机反应的化学方程式
(1)实验室制取乙炔:;
(2)2-溴丙烷与NaOH的醇溶液的反应:;
(3)向苯酚钠溶液中通入少量的CO2;;
(4)由甲苯制取TNT;;
(5)苯甲醇的催化氧化;。
(共12分)根据给出的有机物的结构简式或名称按要求填空:
①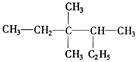 ②
②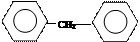 ③
③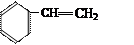
④5,5-二甲基-4-乙基-2-己炔⑤ ⑥
⑥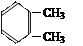
⑦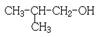

(1)写出①的系统命名法的名称;(2)写出④的结构简式;
(3)属于脂肪烃的是(填序号);(4)属于芳香烃的是(填序号);
(5)属于苯的同系物是(填序号);(6)任写一种与⑧ 互为同分异构体的结构简式。
互为同分异构体的结构简式。