(本题共12分)据报道,日常生活中,将洁厕液与84消毒液混合使用会发生中毒的事故。
23.两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是 ,写出氯原子最外层电子排布的轨道表示式 。
24.84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式______.若将84消毒液长期露置于空气中,溶液中的主要成分将变为 。(填化学式)
25.洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是
A.酸性:HF>HCl>HBr>HI
B.键能:H—F>H—Cl>H—Br>H—I
C.熔点:HF<HCl<HBr<HI
D.还原性:HF<HCl<HBr<HI
26.洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式 。
27.下列氧化还原反应中,与上述反应类型不同的是
A.Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
B.2FeCl3 + Fe → 2FeCl2
C.S + 2H2SO4(浓) 3SO2 + 2H2O
3SO2 + 2H2O
D.KClO3 + 5KCl + 3H2SO4 → 3K2SO4 + 3Cl2 + 3H2O
28.若以物质单位质量得到的电子数衡量物质的消毒效率,则下列常用的消毒剂中,消毒效率最高的是
A.NaClO B.ClO2 C.Cl2 D.Ca(ClO)2
下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:
族 周期 周期 |
0 |
|||||||
| 1 |
IA |
ⅡA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
③ |
④ |
||||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
⑴⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
⑵比较④⑨的氢化物沸点高低顺序并说明理由____________________________。
⑶ lg单质①在常温下完全燃烧生成气态产物放出Q kJ的热量,请写出其表示燃烧的热化学方程式_________________________________________。
⑷由表中两种元素组成的电子数与⑨相同的化合物的化学式为________________。
⑸由⑦⑩两种元素组成的一种化合物,其水溶液呈_________性(填“酸”、“碱”或“中”),其原因_____________________(用离子方程式表达)。
⑹由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式__________________________________。
甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体氧化物,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是________(填化学式);写出 乙→丙转化的离子方程式:_______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________(填化学式);
写出甲→乙转化的离子方程式_________________________________________。
现有NaCl、Na2O2、NaHCO3和Na2SiO3等多种重要的化合物。请用化学式填空:
(1)常作为潜水艇和呼吸面具中氧气来源的淡黄色固体是,所发生主要反应的化学反应方程式为;
(2)常用于焙制糕点,也可用作抗酸药的是 ;
(3)用于制备硅胶和木材防火剂的是。
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。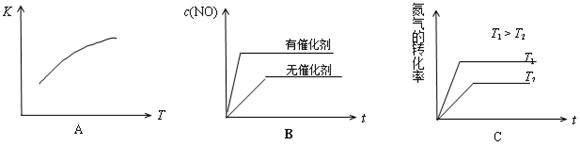
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数(填“变大、“变小”或“不变)
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。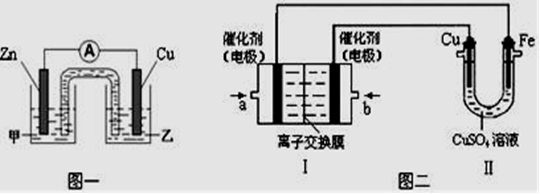
①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是(填“CH4”或“O2”),a处电极上发生的电极反应式是;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是。
| A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(K+)>c(CO32-)>c(H+)>c(OH-) |
| D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-) |
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)