(1)某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
①写出下列物质的化学式:B: ,C E 。
②写出B和D反应生成C的化学方程式:
(2)下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、CO、SO、Cl-中的若干种离子,该小组同学取100 mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1 mol·L-1硝酸,实验过程中沉淀质量的变化如图所示:
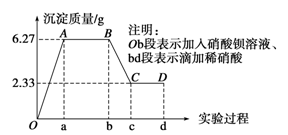
① 水样中一定含有的阴离子是_________________。
② 试根据实验结果推测K+是否存在?________________(填“是”或“否”);
③ 设计简单实验验证原水样中可能存在的离子(写出实验步骤、现象和结论):_________________
(附加题)在某温度下合成氨:N2+3H2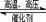 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA______KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低 B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措施为__________。
A.升高温度 B.降低温度
C.增大N2、H2的浓度 D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占的比例较大。
| 容器A |
容器B |
|
| M(平) |
20 |
|
| 平衡时N2的转化率 |
10% |
已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。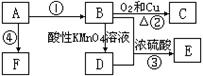
(1)A的最简式为:____________,C的名称:_____________,F的结构简式:____________________________________。
(2)D分子中的官能团名称是_________________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:③____________________________,反应类型_____________。
新合成的一种烃,其碳架呈正三棱柱(如图所示)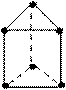
(1)写出该烃的分子式_____________________________。
(2)该烃的一氯代物是否有同分异构体?_______。(填“是”或“否”)
(3)该烃的二氯取代物有_________________种。
(4)该烃的同分异构体有多种,其中一种不能使酸性高锰酸钾溶液或Br2的CCl4溶液褪色,但在一定条件下能跟溴发生取代反应,和H2能发生加成反应,这种同分异构体的结构简式是_______________________________。
短周期元素的单质X、Y、Z在通常状况下均为气态,并有右图转化关系(反应条件略去),已知: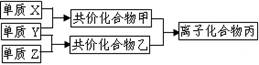
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。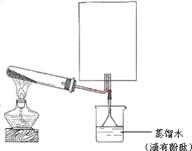
①在图中方框内绘出收集甲的仪器装置简图。
②试管中的试剂是____________________。(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
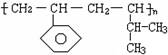
某高分子材料的结构如右图,则其对应的单体的结构简式为:______________________,______________________。