(附加题)在某温度下合成氨:N2+3H2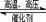 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA______KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低 B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措施为__________。
A.升高温度 B.降低温度
C.增大N2、H2的浓度 D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占的比例较大。
| |
容器A |
容器B |
| M(平) |
20 |
|
| 平衡时N2的转化率 |
|
10% |
用如右图所示气体发生装置可以制取SO2(两种方法)和氯化氢(两种方法)气体,分别写出有关化学反应的化学方程式。
(1)制SO2(氧化还原反应);制SO2(复分解反应)。
(2)制HCl的化学方法:;制HCl的物理方法:烧瓶中盛,分液漏斗中盛。
(3)如果撤去酒精灯,此装置可用于制H2、CO2、H2S及O2,如果用于制O2,烧瓶中盛,分液漏斗中盛,所发生反应的化学方程式为。
(1)按要求写出下列各类具体反应的例子:
①两种弱酸相互反应生成两种强酸:。
②两种弱酸盐相互反应生成两种强酸盐:。
③两种酸溶液相互反应后溶液酸性减弱:。
④一种酸与一种盐溶液反应后溶液酸性增强。。
(2)广西盛产重晶石矿,其主要成分是;以BaSO4为原料通过如下反应可制得BaS:
BaSO4+4C 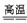 BaS+4CO↑
BaS+4CO↑
①上述反应中,元素被氧化,是氧化剂。
②BaS与盐酸反应可制得BaCl2,在此过程中会产生污染环境的物质,消除污染的方法是,有关的化学反应方程式是。
一烧杯中盛有100mL2mol·L-1的H2SO4溶液,有一表面光滑的塑料小球悬浮于溶液中央(如下图所示),向该烧杯里缓缓注入0.4mol·L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中: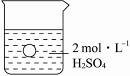
(1)烧杯里观察到的实验现象有:
① 。
② 。
(2)写出实验过程中反应的离子方程式: 。
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):_____________,理由是____________________________________________________。
(2)Y是_____________,Z是_____________,W是_____________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式__________________________。
A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成②B与C反应有沉淀生成③C与D反应有沉淀生成④D与E反应有沉淀生成⑤A与E反应有气体生成⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成沉淀的物质的化学式(分子式)是______________________。
(2)A是____________,B是____________,C是____________,D是____________,E是____________。
(3)A与E反应的离子方程式是_______________________________________________。