A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕ 5。
5。
请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示由元素B和F组成的化合物的形成过程: 。(4)B单质与氧气反应的产物与C的 单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为
 。
。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。
请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在? ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是。(有两个正确选项)
| A.古代活字印刷 | B.原电池工作 | C.简单机械织布 | D.我国古代湿法炼铜 |
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。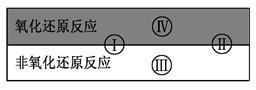
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:其中水为剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl = Cu+CuCl2+N2+H2O
①配平此氧化还原反应方程式
②该反应中,被氧化的元素是(填元素名称),氧化剂是(填化学式)
③反应中若产生0.2mol的气体,则有个电子转移。
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以____________________。
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是_____→洗涤→_____。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式 (K2Cr2O7被还原为Cr3+)。
(5)若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O7 g(保留四位有效数字,已知M(K2Cr2O7)="294.0" g·mol-1)。配制该标准溶液时,下列仪器一定不要用到的有 (用编号表示)。
①电子天平②烧杯③量筒 ④玻璃棒 ⑤250 mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果_______(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将________。
我国目前使用碘酸钾作为食用盐中碘强化剂。并规定,食用盐碘含量的平均水平(以碘元素计)为20 mg/kg ~ 30 mg/kg。
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式。
KIO3+KI+H2SO4=K2SO4+I2+H2O
反应中有1.5mol I2生成时转移电子数是。
(2)已知:I2+2S2O32-=2 I-+S4O62-,某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取20 .0g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②根据以上实验和包装袋说明,所测精制盐的碘含量是mg/kg。(保留一位小数)
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| 原子或分子相关信息 |
单质及其化合物相关信息 |
|
| X |
ZX4分子是由粗Z提纯Z的中间产物 |
X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y |
Y原子的最外层电子数等于电子层数 |
Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z |
Z原子的最外层电子数是次外层电子数的1/2 |
Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W |
W原子的最外层电子数小于4 |
W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积最多为 mL。