煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g)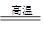 CO(g)+H2(g)
CO(g)+H2(g)
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) ∆H
CH3OH(g) ∆H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(∆H)分别为a、b、c,则上述反应的∆H= 。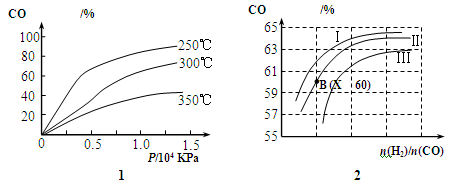
(2)图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比n(H2)/n(CO)、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为 ,理由 。测得B(X,60)点氢气的转化率为40%,则X= 。
(3)一定条件下,将2 mol CO和4 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2 mol,则此时CH3OH(g)的物质的量浓度为 ,平衡常数K= 。下列说法中能说明反应已达到平衡状态的是 (填选项前的字母)。
| A.混合气体的平均摩尔质量不变 |
| B.一氧化碳的消耗速率等于甲醇的生成速率 |
| C.CO和H2的物质的量之比保持不变 |
| D.混合气体的密度不变 |
A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C相邻,C的最外层电子数 是其电子总数的3/4,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
是其电子总数的3/4,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中稳定性由强到弱的顺序是 。
(2)若由A、B、C、D四种元素组成一种离子化合物,1mol该化合物中 含有10mol原子,则该化合物受热分解的化学方程式为 。
含有10mol原子,则该化合物受热分解的化学方程式为 。
(3)Y跟HCl反应生成固体W。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2中的化学键被完全破坏,当有1mol NaNO2发生反应时,共有3mol电子转移,该反应的化学方程式为 。
(4)常温下,pH=5的W的水溶液和HCl的稀 溶液中由水电离出来的H+离子浓度之比为 。
溶液中由水电离出来的H+离子浓度之比为 。
(1)室温时氢氧化钙的溶度积Ksp=4.7×10-6,室温时将9mL 0.02mol·L-1的氯化钙溶液与1mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中
沉淀析出(填有或无)。
(2)2 .24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为 。
.24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为 。
(3)用下图完成相应实验。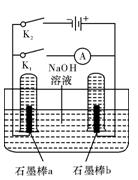
①断开K1,闭合K2接通直流电源,写出阳极的电极反应式 ;
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电 路中有电流通过。写出a极的电极反应式 。
路中有电流通过。写出a极的电极反应式 。
H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体g;
(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是,其物质的量之比是;
某有机化合物A的结构简式如图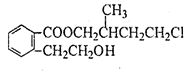 ,回答下列问题:
,回答下列问题:
(1)A的分子式为。
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是。
(3)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为。
(4)C酸化后可得F,F不能发生的反应类型是(填写字母代号) 。
。
a.取代反应 b.加成反应 c.消去反应 d.加聚反应
e.氧化反应 f.还原反应
(5)F可以发生如下转化,且G与H互为同分异构体。
请写出:①H的结构简式。
②由F生成G的化学方程式。
(6)符合下列三个条件的F的同分异构体的数目有个。
①含有邻二取代苯环结构;②与F具有相同的官能团;③不与FeCl3溶液发生显色反应。
甲、乙、丙、丁为前三周期元素形成的微粒,它 们的电子总数均为14。
们的电子总数均为14。
已知:甲为原子;乙、丙、丁为双 原子分子或离子。
原子分子或离子。
⑴甲单质与氢氧化钠溶液反应的离子方程式为 ;
⑵乙是双原子分子,在高温时是一种还原剂。14 g乙燃烧放出的热量是141.5 kJ。写出乙燃烧的热化学方程式。
⑶丙为双原子二价阴离子,与钙离子组成的化合物能跟水反应产生一种可燃性气体。该可燃性气体能与乙酸在一定条件下,按物质的量比1∶1发生加成反应生成一种酯,该化学方程式是为。
⑷由丁分子组成的物质属于单质,组成丁的元素最高价氧化物对应的水化物X有下图所示转化关系(反应条件和其他物质已略)
已知W为金属单质,W在周期表中的位置 。
写出X的稀溶液与Z反应的离子方程式:。