下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: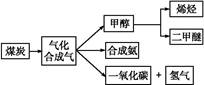
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=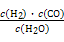 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1="-90.7" kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2="-23.5" kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3="-41.2" kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,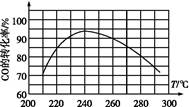
则CO转化率随温度变化的规律是 。
其原因是 。
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:__________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:_________________________
________________________________________________________________________。
(3)写出下列物质的电子式:
①D元素形成的单质:________________________________________。
②E与B形成的化合物:_____________________________________。
③A、B、E形成的化合物:________________________________________。
④D与E形成的化合物:________________________________________。
⑤C、D、E形成的离子化合物:______________________________________。
以下列出了四种物质的分子结构示意图。其中圆圈表示原子核(包含除价电子以外的电子)的示意图,黑点表示非共用电子对,直线表示共价键,且图中各分子仅是由第一、二周期元素的原子构成的。在括号内填写四种物质的分子式。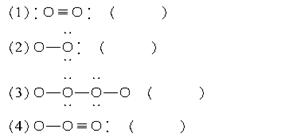
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)________________________;b的氢化物和b的最高价氧化物对应的水化物反应生成Z,则Z的化学式为________,d、e形成化合物的电子式为________________。
(3)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为________________。
有A、B、C三种元素,已知①4 g A元素的单质与水作用,在标准状况下放出氢气2.24 L,反应中有1.204×1023个电子发生转移;②B元素可与A元素形成AB2型的离子化合物,且知A、B的离子具有相同的核外电子排布;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,1 mol该盐含有42 mol电子。
根据以上信息填写下列空白:
(1)元素符号:A:________,B:________,C:________。
(2)A元素的离子结构示意图为__________________________________________。
(3)用电子式表示AB2的形成过程__________________________________
________________________________________________________________________。
(4)C的气态氢化物与B的气态氢化物反应时有________________现象发生,生成物的化学式为________,它属于________化合物。
A+和B2-都与Ar具有相同的电子层结构,则A的元素符号为________,B元素的原子结构示意图为____________,它们形成的化合物的电子式为________________,A+和B2-离子半径大小比较为________________。