某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: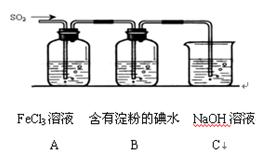
(1)下列实验方案适用于在实验室制取所需SO2的是 ;
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.碳与热浓H2SO4
(2)写出SO2气体通入A中的离子反应___________________________________________;
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,
取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加 入新制的氯水,溶液变红
入新制的氯水,溶液变红
上述方案不合理的是 ,原因是 ;
(4)能表明I-的还原性弱于SO2的现象是 。
(5)下图为SO2的制备和收集装置图:(夹持仪器省略)
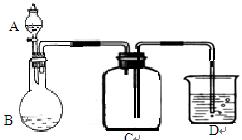
仪器A名称 ,图中的装置错误的是 (填“A、B、C、D”的一个或多个)
该装置气密性检查的操作是
。
肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。
工业上可通过下列反应制备:
(1)请推测B侧链上可能发生反应的类型:(任填两种)
(2)请写出两分子乙醛在上述条件下反应的化学方程式:(3)请写出同时满足括号内条件下的所有同分异构体的结构简式:
(①分子中不含羰基和羟基②是苯的对二取代物③除苯环外,不含其他环状结构。)
已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),另一个产物A也呈酸性,反应方程式如下:
苯甲醛肉桂酸
(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1︰1。产物A的名称是。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为(不要求标出反应条件)
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
可见,取代基对Perkin反应的影响有(写出3条即可):
①②③
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为
(不要求标出反应条件)
(5)Beck反应中,为了促进反应的进行,通常可加入一种显(填字母)的物质
A弱酸性 B弱碱性 C中性 D强酸性
羟基磷灰石[
]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法
:用浓氨水分别调
和
溶液的
约为12;在剧烈搅拌下,将
溶液缓慢滴入
溶液中。
方法
:剧烈搅拌下,将
溶液缓慢滴加到
悬浊液中。
3种钙盐的溶解度随溶液
的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法
和方法B中制备OH
的化学反应方程式:
①
·
=
↓++
②
=
(2)与方法
相比,方法
的优点是。
(3)方法
中,如果
溶液滴加过快,制得的产物不纯,其原因是。
(4)图中所示3种钙盐在人体中最稳定的存在形式是(填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因。
二甲醚(
)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(1)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:。
(2)二甲醚可由合成气(
)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:
_。
(3)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池。该电池中负极上的电极反应式是:。
(4)制备二甲醚的合成气可由甲烷与水燕气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:
①在催化反应室中进行的反应均为可逆反应.增大体系的压强对甲烷转化率的影响是(填"增大"、"减小"或"不变")。
②在上述炼铁过程的某时间段内,若有
(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5
(
/11.2×103
)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进人催化反应室,则这些高温尾气在理论上可产生合成气
(标准状况)。
有机化合物A的分子式是
(相对分子质量为304), 1
在酸性条件下水解得到4
和1
。
分子结构中每一个连有经基的碳原子上还连有两个氢原子。
请回答下列问题:
(1)
与
的相对分子质量之差是。
(2)
的结构简式是:。
(3)
不能发生的反应是(填写序号)
①氧化反应②取代反应③消去反应④加聚反应
(4)己知:
以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成B,写出合成B的各步反应的化学方程式。