二甲醚()被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(1)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:。
(2)二甲醚可由合成气()在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:
_。
(3)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池。该电池中负极上的电极反应式是:。
(4)制备二甲醚的合成气可由甲烷与水燕气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:

①在催化反应室中进行的反应均为可逆反应.增大体系的压强对甲烷转化率的影响是(填"增大"、"减小"或"不变")。
②在上述炼铁过程的某时间段内,若有(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5 (/11.2×103)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进人催化反应室,则这些高温尾气在理论上可产生合成气(标准状况)。
分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线: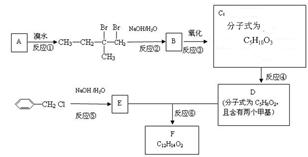
试回答下列问题:
|
(1)按系统命名法给A物质命名 ;
(2)C物质的官能团名称______;E物质的结构简式___________;下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体,E为单质。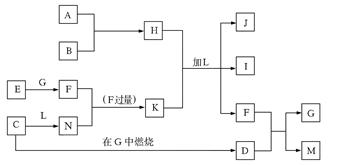
试填写下列空白:
(1)写出F的化学式: _______________。
(2)写出M发生水解的化学反应方程式__________________。
(3)反应C+G→D的化学方程式是_______________。
(4)写出H 、K加L生成J、I、F反应的离子方程式_______________。
下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
| 原子半径(10—10m) |
1.5 |
2.2 |
0.7 |
1.4 |
0.7 |
1.1 |
0.9 |
1.8 |
0.7 |
0.7 |
| 最高价态 |
+1 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
— |
| 最低价态 |
— |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-1 |
(1)以上10种元素的原子中,最容易失电子的是(填写元素符号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是、(写分子式)。某元素R的原子半径为1.02×10—10m,该元素在周期表中的位置是;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核 电荷数A<B<C<:D<E,其中A、B、C是同一周期的非金属元素。化合物DC中存在离子键,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C氢化物的沸点比它们同
电荷数A<B<C<:D<E,其中A、B、C是同一周期的非金属元素。化合物DC中存在离子键,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C氢化物的沸点比它们同 族相邻周期元素氢化物的沸点高。E的原子序数为24。
族相邻周期元素氢化物的沸点高。E的原子序数为24。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的中心原子采取杂化。
(3)写出化 合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为一
合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为一
(4)E的核外电子排布式是。
A、B两元素在周期表中位于同一周期,核电荷数均小于36,最外层均为一个电子,A的次外层为8个电子,B的电子排布式为ls22s22p63s23p63d104s1(或[Ar] 3 dl0
dl0 4s1),则A元素的核外电子排布图为:;
4s1),则A元素的核外电子排布图为:;
B的元素符号为____,位于周期表第周期族。