元素周期表的用途广泛。
(1)用“>”或“<”填空:
| 离子半径 |
非金属性 |
酸性 |
沸点 |
| K+_____S2- |
N____O |
硫酸_____高氯酸 |
HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
海水制取溴:
(1)主要流程: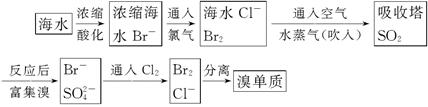
(2)主要反应(化学反应方程式):
_____________________________________。
(3)最后分离实验操作是、
根据所给信息填空
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。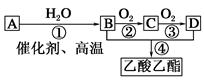
回答下列问题:
(1)A、B、C、D中所有原子都在同一平面上的是________。
(2)写出下列反应的反应类型:①________,④________。
(3) B、D的结构简式,
如图是某种只含有C、H、O、N的有机物简易球棍模型。请回答下列各题。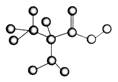
(1)该分子属氨基酸,其分子式为________。
(2)在一定条件下,该分子可以通过聚合反应生成________(填“糖类”“油脂”或“蛋白质”)。
(3)在一定条件下,该分子可以与乙醇发生反应,请写出该反应的化学方程式_________。
冶炼金属常用以下几种方法:
A.以C、CO或H2做还原剂; B.热分解法;
C.利用铝热反应原理还原;D.电解法。
下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
(1)Fe、Zn、Cu等金属;(2)Na、Mg、Al等金属 ______ ;
(3)Hg、Ag等金属;(4)V、Cr、Mn、W等高熔点金属。
海带中含有的碘元素,以I-形式存在,因此可先用将其氧化为________,
然后利用这一特性检验。