海带中含有的碘元素,以I-形式存在,因此可先用 将其氧化为________,
然后利用 这一特性检验。
已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:
(1)在一定温度下,测得硫蒸气的平均摩尔质量为80g/mol,则该蒸气中S2分子的体积分数不小于____。
(2)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH均表示生成1mol产物的数据)。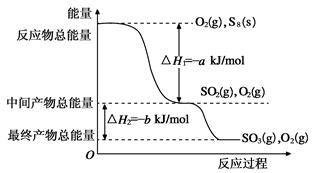
①写出表示S8燃烧热的热化学方程式________________________________________________。
②写出SO3分解生成SO2和O2的热化学方程式________________________________________。
③若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为。
(1)请在下图所示元素周期表中用实线画出主族元素的边界。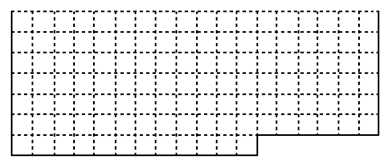
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式。
(4)金属元素丙与两种非金属元素形成的化合物溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式。
(5)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物的电离方程式。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
| C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为。
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为。
【化学—物质结构与性质】
下表为长式周期表的一部分,其中的编号代表对应的元素。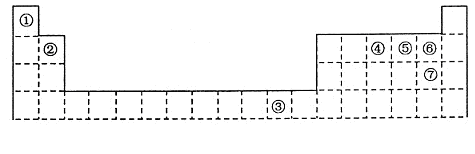
(1)元素③基态原子的价电子排布式为。
(2)②与⑦形成的化合物的空间构型为。
(3)元素④⑤⑥的第一电离能由大到小的顺序是(填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是。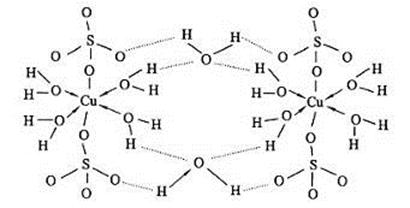
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.胆矾CuSO4·5H2O中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:在NF3分子中,。(已知电负性:F>N>H)
高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO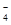 +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO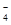 +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②配平后2种反应物前面的系数:MnO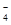 +CuS+…..
+CuS+…..
II:在稀硫酸中,MnO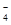 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +8H++5e-===Mn2++4H2O
+8H++5e-===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是mol。
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(5)用软锰矿制备K2MnO4的化学方程式是:。
(6)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是。(用“>”“<”或“=”表示)。