以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: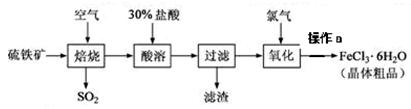
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是 ( )
| A.玻璃棒 | B.烧杯 | C.托盘天平 | D.500mL量筒 |
E、500mL容量瓶 F、胶头滴管
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、
。
(4)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。
(5)操作a为 、过滤、洗涤、干燥。
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子 数相等。请回答下列问题:
(1)X元素的名称是________________
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________
(3)写出F的电子式______________________________
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分
别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式
__________________________________,;
B中含有的化学键是;
请举一例说明B的用途______________________________________________________
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________
已知某烃A含碳元素的质量分数为85.7%。结合以下信息回答问题:
(1)若烃A密度是相同状况下氢气密度的42倍。
则烃A的相对分子质量_____________,分子式为_____________。
(2) 若烃A可作果实催熟剂。
则由A制取高分子化合物的化学方程式为
A和水在一定条件下反应生成B。B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式
下列各组物质:
① O2和O3 ; ② 1H、2H、3H; ③ CH4和C10H22; ④乙烷和(CH3)2CHCH2CH3;
⑤ 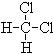 和
和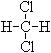 ;⑥
;⑥ 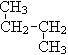 和
和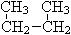
⑦ CH3 (CH2) 3 CH3和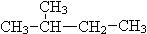
(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同系物的是;
(4)互为同分异构体的是;(5)属于同一物质的是。
已知有机物A~F有如图转化关系: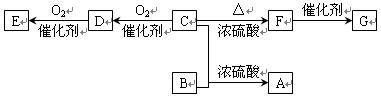
已知:①A的分子式为C8H16O2;
②C分子中只有1个甲基;
③B、E 互为具有相同官能团的同分异构体,且均能与碳酸氢钠反应放出CO2,
④又已知醇在浓硫酸、加热条件下能发生以下类似的反应: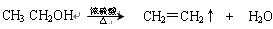
⑤ F能使溴水褪色,G为高分子化合物。
请填写以下空白:
(1)C可能发生的反应有______________________ (填序号)。
①取代反应②加成反应③加聚反应④氧化反应
(2)写出E的结构简式____________________________________________。
写出F与溴的四氯化碳溶液反应生成的有机物的结构简式___________________。
(3)写出下列转化的化学方程式。
B+C→A:_________ C→D:_________ F→G:____________
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出F在周期表中的位置________。画出D的离子结构示意图___________。
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_______________。1gA的单质与C的单质完全反应生成Y(Y为液态),放出142.9KJ的热量,请写出该反应的热化学方程式_______________________。
(3)C与F形成的常见化合物属于_________晶体。若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T, R、S、T三者的沸点从高到低排列为___________________________(写化学式)。
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B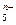 电子式
电子式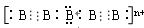 ,则n值为___。
,则n值为___。
(5)A的单质与C的单质在KOH的溶液中可以形成原电池,已知M、N均为碳电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为____________________________________。
(6)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol·L—1,则平衡时FC2的转化率为________。