现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
原子的电子排布图为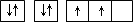 |
| B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
| C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D |
二价阳离子与C的阴离子具有相同的电子层结构 |
| E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ,该氢化物的等电子体是 ;
(3)E的价电子排布式是 ,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为 ;
(4)AC2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为 ;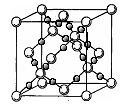
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
下列说法不正确的是:
| A.煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 |
| B.测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义。 |
| C.利用盐类的水解反应可以制备胶体、对饮用水进行净化,也可以获得纳米材料。 |
| D.化学电池必须回收处理,其主要目的就是回收碳棒再利用。 |
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的电子式。
(2) B、D分子中的官能团名称分别是.。
(3)写出下列反应的反应类型:①______________,②_______________。
(4)写出下列反应的化学方程式:
①;
②。
根据下列要求,从①H2O②CH2=CH2 ③CH3COOH④Na2CO3 ⑤HNO3 ⑥(C6H10O5)n⑦CH3CH2OH中选择恰当的反应物(用序号填写),并写出对应的化学方程式。
| 反应物 |
化学方程式 |
反应类型 |
|
| (1)与苯发生取代反应 |
苯和______ |
||
| (2)表示酒越陈越香的原理 |
⑦和______ |
||
| (3)说明乙酸酸性比碳酸强 |
③和______ |
||
| (4)咀嚼米饭时有甜味的原因 |
____和_____ |
(9分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:
(1)Na3N的电子式__________________,该化合物是由______________键形成。
(2)Na3N与水反应方程式为____________________________________________,该反应属___________________(填基本反应类型)反应。
(3)Na3N放入足量盐酸中生成_______种盐,其化学式为__________________。
(4)比较Na3N中两种粒子的半径:r(Na+)___r(N3-)(填“>”“=”或“<” )