运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:N2H4+O2=N2+2H2O,若将此反应设计成如图所示的原电池装置,请回答:
①负极反应式为: ▲ ;
②工作一段时间后正极附近溶液的pH变化为 ▲ (填“增大”“减小”或“不变”);
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为 ▲ 。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,首先生成 ▲ 沉淀(填化学式),生成该沉淀的离子方程式为 ▲ 。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c(Cl-),则溶液显 ▲ 性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb= ▲ 。
硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式:。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10—7 K2=4.7×10—11 |
K=1.75×10—5 |
下列说法正确的是。
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
某有机物A在酸性溶液中加热可发生如下反应:
请回答下列问题:
(1)下列关于该有机物A说法错误的是。
①可发生银镜反应②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为;B在铂的催化下,与足量氢气发生加
成反应生成X,则X的结构简式为。
(3)有机物R的结构简式为; R与足量的醋酸发生反应(填基本反应类型)的化学方程式为:
。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。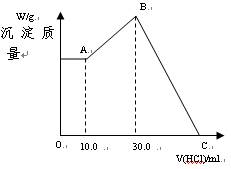
试回答:
(1)A点的沉淀物的化学式为,理由。
(2)写出A点到B点发生反应的离子方程式。
(3)原混合物中MgCl2的质量是,AlCl3的质量是,NaOH的质量是。
(4)C点溶液的体积为mL。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题: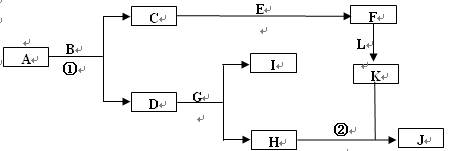
(1)A的电子式。
(2)反应①的化学方程式为,反应②的离子方程式为,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为L。