X、Y、Z、Q、E五种元素中,X原子核外M层中只有两对成对电子,Y原子核外L层电子数是K层两倍,Z是地壳内含量(质量分数)最高元素,Q核电荷数是X与Z核电荷数之和,E电负性最大。
(1)相同条件下XZ2与YZ2分子在水中溶解度较大是 ,理由是
;
(2)Q的外围电子排 布为 ,在形成化合物时它的最高化合价为 ;
布为 ,在形成化合物时它的最高化合价为 ;
(3)在测定E的气态氢化物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
科学家预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂作用水解成葡萄糖,再将葡萄糖转化为乙醇,用作燃料.
(1)写出绿色植物的秸秆转化为乙醇的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________.
(2)乙醇还可用于合成其他有机物,如图是用乙醇为起始原料合成环状酯D的框图,请在方框内填入相应有机物的结构简式: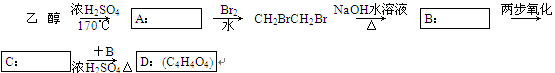
(3)写出B+C―→D的化学方程式:________________________________________
_______________________________________________________________________.
分别取1 mol葡萄糖进行下列试验:
(1)银镜反应时,生成Ag的物质的量为________ mol,反应后葡萄糖变为________,其结构简式是______________________________.
(2)与乙酸反应生成酯,从理论上讲完全酯化需要________ g乙酸.
(3)若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为________ L,反应的化学方程式是________________________________.
据新华社2009年5月9日电, 国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义。请回答下列问题:
(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质。请回答下列问题。
①下列说法不正确的是。
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:
MnFe2O4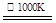 MnFe2O4-X+(X/2)O2
MnFe2O4-X+(X/2)O2
则第二步反应的化学方程式为(条件不写)。
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是。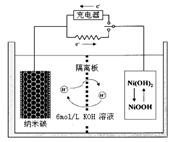
A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e—=Ni(OH)2+OH—
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据。已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3。
| 物质 |
H2 |
CO |
CH4 |
| 热值/kJ·g–1 |
143 |
10 |
56 |
①根据以上热值数据,是最理想的燃料。
②家庭使用管道煤气和天然气, 更经济合算。
③表示CO燃烧热的热化学方程式为 。
非金属元素R,其单质4.8g在氧气中充分燃烧生成RO29.6g,在R原子中,核内质子数等于中子数,则R的元素名称为,其最高价为,与左右相邻元素比较,R的氢化物比稳定,R的最高价氧化物的水化物酸性比弱。
如图甲、乙是电化学实验装置。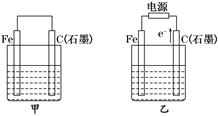
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为____________________________________________。
②乙中总反应的离子方程式为______________________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________________________________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为____________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________ g。