由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行反应:X(g)+Y(g) nZ(g) 经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
nZ(g) 经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
(1)该化学反应的正反应方向是_______热反应。
(2)T1表示该反应在时间t内可达平衡的_____(填“最高”或“最低”)温度。
(3)在T<T1的某一温度内,该反应______(填“能”或“不能”)建立平衡。
(4)在温度T2时增大压强,达新平衡时ω(Z)将增大,则系数n的值是_______,向_____移动。
现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH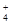 )_________c(Cl—)。
)_________c(Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH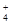 )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: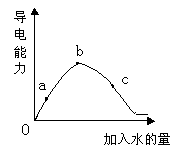
(1)“O”点导电能力为0的理由是: 。
(2)a、b、c三点溶液中,[H+]由小到大的顺序是: 。
(3)a、b、c三点溶液中,醋酸的电离程度最大的是: 。
(4)若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:① ;② ;③ ;④ 。
(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为:
②当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3·H2O)_______n(HCl),溶液中c( NH4+)_______c(Cl-)。(填“>”或“<”或“=” )
(2)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_ __和_ _两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl 溶液
②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液
④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl ⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中
c(NH4+) c(Cl-)(选填“ >”“=”“<”)。