现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
硫与热KOH浓溶液发生反应:3S + 6KOH 2K2S + K2SO3 + 3H2O
2K2S + K2SO3 + 3H2O
(1)反应中氧化剂与还原剂的质量比为________________;
(2)每 1 mol S 起反应,电子转移数为________________;
(3)每生成 2 mol K2SO3,被还原的硫为________________mol。
下表表示的是元素周期表中短周期元素,根据要求回答下列问题:
| ⑧ |
|||||||
| ① |
② |
③ |
④ |
||||
| ⑤ |
⑥ |
⑦ |
(1)④⑥元素气态氢化物的稳定性比较> (写化学式)
(2)③号元素与其他元素可形成10个电子的阳离子和阴离子,其离子符号分别为、。
(3)用电子式表示⑧和③元素形成A2B型化合物的过程。
(4)用电子式表示⑤和⑥元素形成A2B型化合物的过程。
36 g的H2O 和 60 g 的D2O 中, 它们所含有的原子总数之比为,分子内的中子总数之比为,若它们分别与足量的金属钠反应, 产生的气体的质量之比为。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断: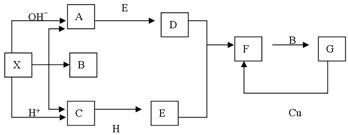
(1)化学式X;
(2)A的电子式为;空间构型;
C的结构式为;H所包含的化学键类型。
(3)工业上制取A的化学反应方程式;A→D的化学反应方程式;
C+H→E的化学反应方程式;G→D的离子反应方程式。
有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后变为无色溶液;在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀部分溶解并有气体放出,由此推断:
(1)原固体肯定有__________,(2)原固体肯定不存在_____________________。
(3)_____不能确定存在与否,要确定其存在,应进行的实验是___。