用铂电极电解CuSO4溶液,当c(Cu2+)降至原来的一半时停止通电,则加入下面物质能使溶液恢复成原来浓度的是( )
| A.无水CuSO4 | B.CuO | C.Cu(OH)2 | D.CuSO4·5H2O |
下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10mL 0.01 mol·L-1 HCl溶液与10mL 0.01 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸的强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
下面各项中的两个量,其比值一定为2:1的是
| A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积 |
| B.相同温度下,0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+) |
| C.常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) |
| D.铜与浓硫酸共热反应中,消耗的Cu与被还原的H2SO4的物质的量 |
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21。下列说法正确的是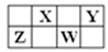
| A.W元素的单质属于原子晶体。 |
| B.X元素的非金属性比Y元素非金属性强 |
| C.Z和X能以共价键结合形成一种无机非金属材料 |
| D.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g) 4C(s)+2D(g) ,反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s)+2D(g) ,反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
A.该反应的化学平衡常数表达式是 |
| B.其他条件不变,增加B,平衡向右移动,B的平衡转化率增大 |
| C.其他条件不变,增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.此时,B的平衡转化率是40% |
在硫酸铝、硫酸钾和明矾的混合溶液中,测得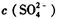 =0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
=0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225 mol/L | B.0.25 mol/L | C.0.45 mol/L | D.0.9 mol/L |