右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时 间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )

| A.在①中Cu棒为阳极;在②中Cu棒为负极 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑ ②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
能正确表示下列反应的离子方程式是
| A.少量的CO2通人氨水中:CO2+NH3·H2O=NH4++HCO3- |
B.Na2O2溶于水中:2Na2O2+2H2O=4Na++4OH-+O2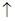 |
| C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
D.用惰性电极电解熔融氯化钠:2C1-+2H2O Cl2 Cl2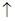 +H2 +H2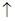 +2OH- +2OH- |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,2.24 L CH4中含有0.4NA个共价键 |
| B.100 mL l mol·L-1 Na[Al(OH)4]溶液中含有0.1以个[Al(OH)4]- |
| C.常温条件下,5.6gFe与足量稀HNO3反应,转移0.2NA个电子 |
| D.标准状况下,1.12 L 1H2和0.2g2H2均含有0.1NA个质子 |
下列陈述I、Ⅱ均正确且有因果关系的是
| 选项 |
陈述I |
陈述Ⅱ |
| A |
常温下铁与浓硫酸不反应 |
可用铁槽车密封运送浓硫酸 |
| B |
NaHCO3溶于水完全电离 |
NaHCO3是强电解质 |
| C |
NH4Cl为强酸弱碱盐 |
用加热法除去NaCl中的NH4Cl |
| D |
H2O2、SO2都能使酸性KMnO4溶液褪色 |
H2O2表现还原性,SO2表现漂白性 |
某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(NH4+)随反应进行逐渐减小。下列判断错误的是
| A.反应的氧化剂是ClO- |
| B.消耗l mol还原剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
下列叙述正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
| D.IA族与VIIA族元素间可形成共价化合物或离子化合物 |