与主族元素在周期表中所处的位置有关的是( )
| A.相对原子量 | B.核内中子数 | C.次外层电子数 | D.电子层数和最外层电子数 |
如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)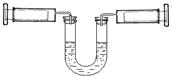
| A.压缩后U型管内两侧液面仍然保持水平 |
B.对于2NO2 N2O4平衡体系,向生成N2O4的方向移动 N2O4平衡体系,向生成N2O4的方向移动 |
| C.左侧气体颜色先变深后逐渐变浅(比原来深) |
| D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),△H="-1025" kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g),△H="-1025" kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是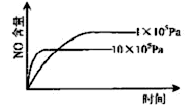
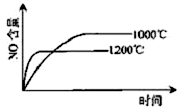
A. B.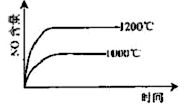
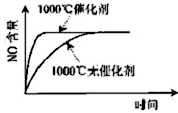
C.D.
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g) 3C(g)+2D(g),达到平衡状态的是
3C(g)+2D(g),达到平衡状态的是
A.混合气的平均相对分子质量不再改变
B.反应器内A、B、C、D物质的量比为1:3:3:2
C.容器内密度不随时间变化而变化
D.生成 1mol A同时有3 mol C被消耗
下列说法不正确的是
| A.能够发生有效碰撞的分子叫做活化分子 |
| B.加入反应物,活化分子百分数增大.化学反应速率增大 |
| C.升高温度,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
下列热化学方程式或离子方程式中,正确的是
| A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H= -38.6kJ·mol-1 2NH3(g) △H= -38.6kJ·mol-1 |
| C.氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O |