二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )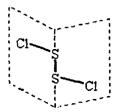

A.S2Cl2固体为分子晶体 |
||
B.S2Cl2为含有极性键和非极性键的非极性分子 |
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
D.S2Cl2中硫元素化合价为+1,与H2O反应可能属于氧化还原反应,方程式如下: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl 2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
下列热化学方程式或离子方程式中,正确的是
| A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
B.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)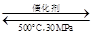 2NH3(g);ΔH=-38.6 kJmol-1 2NH3(g);ΔH=-38.6 kJmol-1 |
| C.氯化镁溶液与氨水反应:Mg2++2OH-===Mg(OH)2↓ |
D.氧化铝溶于NaOH溶液:Al2O3+2OH-===2AlO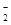 +H2O +H2O |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,
Na2O2(s)+CO2(g)===Na2CO3(s)+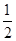 O2(g)ΔH=-226 kJ·mol-1。
O2(g)ΔH=-226 kJ·mol-1。
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
下列热化学方程式中的ΔH能表示物质燃烧热的是
| A.2CO(g)+O2(g)=2CO2(g) ΔH =" -" 566 KJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH =" -" 890 KJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH =" -" 571.6 KJ·mol-1 |
| D.H2(g)+Cl2(g)="2HCl(g)ΔH" =" -" 184.6 KJ·mol-1 |
下列说法正确的是
| A.在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol |
| B.在10l k Pa时,l mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2燃烧热为—285.8KJ/mol |
| C.鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D.在稀溶液中:,若将0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
在下列各说法中,正确的是
| A.△H >0表示放热反应,△H <0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 molH2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 molH2与0.5 mol O2反应放出的热就是H2的燃烧热 |