(8分)在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③
④
⑤ ⑥甲烷与丙烷
⑥甲烷与丙烷
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
注意:以上七组物质,不一定是每组物质都能找到对应填空
⑴互为同位素的是 ▲ ;⑵互为同分异构体的是 ▲ ;
⑶互为同系物的是 ▲ ;⑷同一种物质的是 ▲ 。
(16分)实验室需要80mL 2mol/L碳酸钠溶液。回答下列有关配制该溶液的问题(实验室中没有80mL规格的容量瓶):
(1)所需要的仪器为:托盘天平、量筒、烧杯、玻璃棒、_________、_________。
(2)配制该溶液需要Na2CO3的质量为_________g。
(3)配制溶液的操作顺序是(填序号)_________。
①转移溶液;②轻摇使溶液混合均匀; ③洗涤并转移洗涤液;④加盖倒转摇匀溶液; ⑤定容; ⑥称量⑦溶解;⑧计算
(4)正式配制前必须进行的一项实验操作是__________________。
(5)试分析下列操作对所配溶液的浓度有何影响:(填写编号)
A.偏高;B.不变;C.偏低。
①配制溶液时未洗涤烧杯并转移洗涤液_________;
②定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线_________;
③定容时俯视刻度线_________。
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物
填空和回答下列问题
(1)B物质是(写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,此杂质的化学式为,因为上述方案中某一步设计有毛病,这一步的正确设计方案应是。
(3)写出生成沉淀B的离子方程式
(4)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是
下图中A~H均为中学化学中常见的物质。已知A为紫红色金属,D能使品红溶液褪色,E为生活中常见的无色无味液体,F为黄绿色气体。请回答下列问题: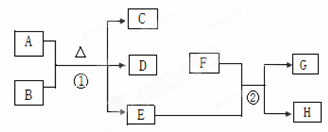
(1)反应②中能起杀菌消毒作用的化合物是(填名称)
(2)反应①的化学方程式为。
(3)D物质造成的环境问题是,实验室常用过量的NaOH溶液来吸收它,该反应的离子方程式为
(4)待A(足量)与B反应停止后,反应混合液中的B仍有剩余。其原因是。
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去)。已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质。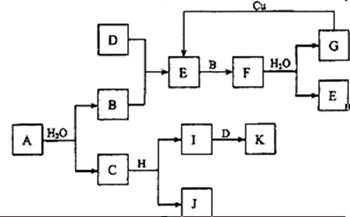
回答下列问题:
(1)写出化学式A______,F_______,G_______,H_______,J________,K________,。
(2)写出实验室制取K的化学方程式__________________________________________。
(3)写出G→E的化学方程式_________________________________________________;
此反应中,氧化剂和还原剂的物质的量之比是_____________;
0.3mol Cu完全反应,被还原的G为_____________mol。
(4)检验C中阳离子的实验方法是____________________________________________。
(5)实验室中保存的C溶液可能会变质,为了检验C溶液是否变质,分别取少量样品进行如下实验,其中能达到实验目的的是__________(填序号)。
a.向样品中滴加稀硝酸,观察现象
b.向样品中滴加氢氧化钡溶液,观察现象
c.向样品中滴加酚酞试液,观察现象
d.向样品中滴加氯化镁溶液,观察现象
已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,基态原子中电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每种能量不同的原子轨道中的电子数相同;C基态原子核外成对电子数为未成对电子数的3倍;D与C同主族;E、F位于同一周期和同一族,且E比F的核电荷数小2。
(1)E3+的核外有个未成对电子,A2C2的电子式为。
(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有。(填代号)
A.非极性键 B.极性键 C. s—sσ键 D.s—pσ键
E.p—p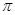 键 F.s—sp3σ键 G.sp3—sp3σ键 H.sp3—sp3 π键
键 F.s—sp3σ键 G.sp3—sp3σ键 H.sp3—sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| A2D |
187 |
202 |
2.6 |
| A2C2 |
272 |
423 |
以任意比互溶 |
A2D和A2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。