现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4 ②ls22s22p63s23p3
③ls22s22p3 ④ls22s22p5 , 则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
在0.1 mol·L¯1的CH3COOH溶液中存在如下电离平衡: CH3COOH 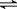 CH3COO¯+H+,对于该平衡,下列叙述正确的是()
CH3COO¯+H+,对于该平衡,下列叙述正确的是()
| A.加入少量NaOH固体,平衡向正反应方向移动; |
| B.加水,反应速率增大,平衡向逆反应方向移动; |
| C.滴加少量0.1mol·L¯1HCl溶液,溶液中c(H+)减少; |
| D.加入少量CH3COONa固体,平衡向正反应方向移动; |
下列说法中正确的是()
| A.凡是放热反应都是自发的,吸热反应都是非自发的 |
| B.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| C.熵增加且放热的反应一定是自发反应 |
| D.非自发反应在任何条件下都不能实现 |
温家宝总理在全国人大会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是()
| A.用“绿色化学”工艺,使原料完全转化为目标产物 |
| B.开发新能源,减少化石能源的使用,减少污染 |
| C.开发新型电池,推广废旧电池的回收、处理经验 |
| D.大量使用农药化肥,减少病虫害,提高粮食产量 |
把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
| A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
| B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C.t=c时反应处平衡状态 |
| D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法正确的是
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7 |
| B.25℃时,0.2mol/LBa(OH)2溶液和0.2mol/LHCl溶液等体积混合,所得溶液的pH等于7 |
| C.25℃时,0.2mol/LBa(OH)2溶液和0.2mol/L乙酸溶液恰好中和,所得溶液的pH等于7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |