在0.1 mol·L¯1的CH3COOH溶液中存在如下电离平衡: CH3COOH 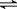 CH3COO¯+H+,对于该平衡,下列叙述正确的是 ( )
CH3COO¯+H+,对于该平衡,下列叙述正确的是 ( )
| A.加入少量NaOH固体,平衡向正反应方向移动; |
| B.加水,反应速率增大,平衡向逆反应方向移动; |
| C.滴加少量0.1mol·L¯1HCl溶液,溶液中c(H+)减少; |
| D.加入少量CH3COONa固体,平衡向正反应方向移动; |
下列物质的分类中,前者包括后者的是()
| A.化合物、纯净物 | B.悬浊液、胶体 |
| C.分散系、溶液 | D.氧化物、化合物 |
能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-=CO32-+H2O |
| C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3- |
| D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
| A.原子半径:N可能比Y大,也可能比Y小 |
| B.M2+、N2-核外电子数:可能相等,也可能不等 |
| C.原子序数:N>M>X>Y |
D.碱 性:M(OH)2>YOH 性:M(OH)2>YOH |
下列判断正确的是
| A.0.5molNaCl溶解在1 L水中,所得溶液的物质的量浓度为0.5 mol/L |
| B.10mL 1 mol/L的硫酸溶液与100mL 1 mol/L的硫酸溶液的物质的量浓度不同 |
| C.1mol任何气体所含的气体分子数目都相等 |
| D.1molCH4的体积约为22.4L |
120 mL含有0.2 0 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
0 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.1.5 mol/L | C.0.18 mol/L | D.0.24mol/L |