短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 |
有关信息 |
| X |
最外层电子数是次外层的2倍 |
| Y |
元素主要化合价为–2价 |
| Z |
其单质及化合物的焰色为黄色 |
| M |
与X同主族,其单质为半导体材料 |
| N |
 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图,该反应的△H 0(填“>”“<”或“=”);若T1、T2时反应的化学平衡常数分别为K1、K2,则K1 K2(填“>”“<”或“=”)。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图,该反应的△H 0(填“>”“<”或“=”);若T1、T2时反应的化学平衡常数分别为K1、K2,则K1 K2(填“>”“<”或“=”)。
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。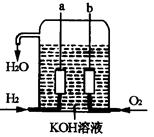
(1)a极是极,b极是极,电极
反应式分别为,。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率。 [2H2(g)+O2(g) 2H2O(l)+572kJ]
[2H2(g)+O2(g) 2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下的H2多少升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式:。此时电池内总的反应方程式为。
下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g)△H1=" a" kJ·mol-1
FeO(s)+CO(g)△H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g)△H2=" b" kJ·mol-1
2CO2(g)△H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s)△H3
2FeO(s)△H3
(1)则△H3=(用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有(填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为。
。则在电解法合成氨的过程中,应将H2不断地通入极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
乙烯是重要的化工基础原料。用乙烯合成光学树脂CR-39单体的过程如下:
已知:i.CR-39单体结构简式是:
ii.酯与醇有如下反应:
(1)乙烯转化为A的反应类型是_______,B中官能团名称是_______。
(2)在D、E的分子中,都只有一种化学环境的氢原子。
① D的结构简式是_______。
② E为五元环状化合物,E与CH3OH反应的化学方程式是_______。
(3)G与足量NaOH溶液反应的化学方程式是_______。
(4)F的一种同分异构体K,其分子中不同化学环境的氢原子个数比是3∶1∶1∶1,且能与NaHCO3反应。
① K能发生消去反应,生成的有机物的结构简式是_______。
② K在一定条件下合成高分子化合物的化学方程式是_______。
(5)下列有关C的叙述正确的是(填写序号)_______。
a.能与乙酸发生酯化反应
b.能与乙醇发生酯化反应
c.1 mol C最多能与2 mol Na反应
d.C的同分异构体不能发生银镜反应
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是_______。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: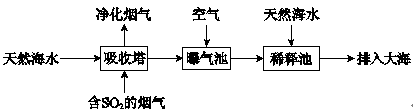
①向曝气池中通入空气的目的是_______。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是_______。
a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_______。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______。
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)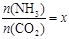 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
③上图中的B点处,NH3的平衡转化率为_______。