某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立方体中心。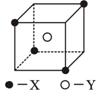
试分析:
(1)晶体中每个Y同时吸引着__________个X,每个X同时吸引着__________个Y,该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有_________________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为NA mol-1,计算此晶体中两个距离最近的X中心间的距离______________________cm。
I.用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)
(1)最高价氧化物的水化物碱性最强的是;其电子式为:
(2)最高价氧化物的水化物呈两性的是;
(3)能形成气态氢化物且最稳定的是,其电子式为.
II.化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
下列说法错误的是。
| A.将Cl2通入紫色石蕊试液,溶液先变红后褪色 |
| B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体 |
| D.常温下,可以用铁质容器储运浓硝酸 |
E.实验室可以用加热氯化铵的方法制取少量氨气
F.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是_______________________________________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是____。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是__________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个填代号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(多选不限,填代号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是____________。
(3)已知t°C,KW=1×10-13,则t°C______(填“>”、“<”或“=”)25°C。
(4)25°C时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和。两溶液的pH(x、y)的关系式为________________(填表达式)。
将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中c(A-)______c(HA);
(2)混合溶液中c(HA)+c(A-)______0.1 mol·L-1;
(3)混合溶液中由水电离出的c(OH-)__________0.2 mol·L-1HA溶液中由水电离出的
c(H+);
(4)25°C时,如果取0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO 、H+、CO
、H+、CO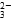 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。
(2)常温下,物质的量浓度均为0.1 mol·L-1的六种溶液①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为____________。
(3)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________________________
实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的________(填写物质的名称),把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(4)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(NH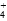 )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。