工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是_______________________________________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是____。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是__________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个填代号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(多选不限,填代号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。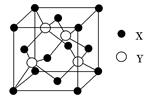
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________。
(4)Y与Z可形成YZ42-。
①YZ42-的空间构型为________(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:________。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
短周期元素在元素中占有重要地位。X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: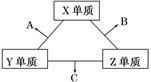
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是____________周期________族。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在________。
(3)在C分子中,Y原子的杂化方式为________,与Y原子同主族在第四周期的元素原子基态电子排布式是____________________________________________________________。
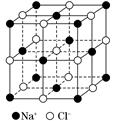
(4)NaCl的晶体结构如图所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构。则该X的氧化物的化学式为___________________________________________________。
砷化镓广泛用于雷达、电子计算机、人造卫星,宇宙飞船等尖端技术中。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
(1)砷化镓的化学式为____________。
(2)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是________(用氢化物分子式表示)。
(3)比较二者的第一电离能:As________(填“<”“>”或“=”)Ga。
(4)下列说法正确的是________(填字母)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.砷化镓晶体中与同一个镓原子相连的砷原子构成正四面体 |
| C.电负性:As>Ga |
| D.砷化镓晶体中含有配位键 |
(1)下列是A、B、C、D、E五种短周期元素的某些性质。
| A |
B |
C |
D |
E |
|
| 化合价 |
-4 |
-2 |
-1 |
-2 |
-1 |
| 电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
4.0 |
①E原子的核外电子排布式为________;
②上表中的元素可以组成分子式为ADC2的物质,该物质中所有原子最外层均满足8电子稳定结构。则该分子的结构简式为________;中心原子的杂化方式为________;
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为________;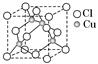
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________________。
下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)在仪器上标明具体使用温度的是(不考虑温度计)_______(填写编号);可作反应容器并可加热的是________(填写编号)。
(2)需要用温度计的实验是________(填写编号)。
①石油分馏 ②浓硫酸稀释 ③测定硝酸钾的溶解度
(3)玻璃棒的作用主要有以下三种。不同实验中其作用可能不完全相同,请回答下列问题:
①搅拌 ②引流 ③蘸取溶液
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是________(填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是________(填写编号)。