(1)下列是A、B、C、D、E五种短周期元素的某些性质。
| |
A |
B |
C |
D |
E |
| 化合价 |
-4 |
-2 |
-1 |
-2 |
-1 |
| 电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
4.0 |
①E原子的核外电子排布式为________;
②上表中的元素可以组成分子式为ADC2的物质,该物质中所有原子最外层均满足8电子稳定结构。则该分子的结构简式为________;中心原子的杂化方式为________;
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为________;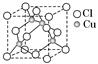
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________________。
㈠如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。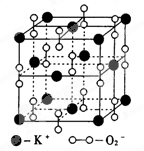
⑴该结构与的结构相似(填选项字母,下同)
A.NaCl B.CsCl C.干冰 D.SiO2
⑵钾、氧两元素所形成化合物的化学式是
A.K2O B.K2O2 C.K2O3 D.KO2
⑶下列对KO2晶体结构的描述正确的是
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3: 1
㈡如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解池,其电极材料见右图: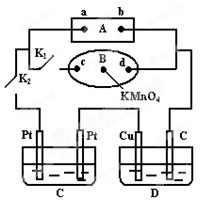
⑴关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为极,通电一段时间后,观察到滤纸d端的电极反应式是;
⑵已知C装置中溶液为Cu(NO3)2和Y(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。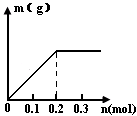
则Cu2+、Y3+、H+氧化能力由大到小的顺序是;D装置中溶液是H2SO4,则电极C端的实验现象是_____。
右图所示为相互串联的甲、乙两电解池,试回答:
⑴若甲池利用电解原理在铁上镀银,则A电极材料是________,电极反应式是________________,B是_______极,应选用的电解质溶液是________;
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____色,
C极附近呈_______色;
⑶若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标况下的体积是________mL;
⑷若乙池中剩余溶液仍为400 mL,则电解后所得NaOH溶液的物质的量浓度为________mol/L,pH等于
________。
㈠已知涤纶树脂的结构简式为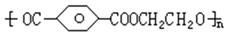 ,写出合成涤纶树脂所需的单体的结构简式;
,写出合成涤纶树脂所需的单体的结构简式;
㈡A、B两种有机化合物,分子式都是C9H11O2N;
⑴化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基(-CH3),化合物A的结构简式是________________________;
⑵化合物B是某种分子式为C9H12的芳香烃一硝化后的唯一产物(硝基连在苯环上),化合物B的结构简式是________________________。
(9分)㈠金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示:
⑴等量金刚石和石墨完全燃烧__________(填“金刚石”或“石墨”)放出热量更多,写出表示石墨燃烧热的热化学方程式______________________________;
⑵在通常状况下,金刚石和石墨相比________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式__________________________;
⑶12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量。
㈡⑴家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50KJ。试写出丁烷燃烧反应的热化学方程式;
⑵已知含KOH 28.0g稀溶液与足量稀硫酸反应,放出28.65KJ的热量,试写出该反应中和热的热化学方程式。
某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
  时间 时间浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
⑴在实验1,反应在20至30分钟时间内用A表示表示该反应的平均速率为________。
⑵在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_______________________________。
⑶设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填“<”、“=”或“>”),且c3_______1.0 mol/L(填“<”、“=”或“>”)。
⑷比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是___________________________________________________________。