已知25°C时:
| 电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积 |
1.8×10-11 |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 完全沉淀时的pH |
9.7 |
5.0 |
5.5 |
4.0 |
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为________(填化学式)而除去。
(2)试剂a为________。
(3)写出②中除杂所发生的总反应的离子方程式:________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在
有机化合物A~H的转换关系如下所示: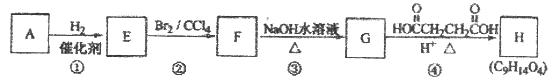
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,则A的分子式为,结构简式是:
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是;
(3)①的反应类型是;③的反应类型是
(4)G与金属钠反应能放出气体,由G转化为H的化学方程式是
某有机物A(相对分子质量为74)可在一定条件下氧化成无支链的B(碳原子数不变),转化关系如图所示(部分反应条件和产物略),其中有机物G的分子结构中不含溴。
已知:

(1)A的分子式为,E中含有的官能团名称为,D的结构简式为。
(2)A→E反应的化学方程式为。F→G的反应类型为。
(3)E在一定条件下可加聚生成聚合物H,H的结构简式为。
(4)与A同类的所有同分异构体的结构简式为:。
下列有机物:
①HOCH2CH2OH ②HOCH2CH(OH)CH2OH
③(CH3)3CCH2OH ④(CH3)3COH ⑤C(CH2OH)4
⑥CH3CH2-O-CH2CH3 ⑦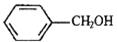
(1)不能发生消去反应的醇是:。
(2)不能发生催化氧化(去氢氧化)的醇是:。.
(3)互为同系物的是:。
(4)互为同分异构体的是:。
请写出四种有机化合物的分子式,这些化合物燃烧后产生的CO2和H2O(g)的体积比符合如下比值(各写两种):
(1)V(CO2)/V(H2O气)=2的有。
(2)V(CO2)/V(H2O气)=0.5的有。
(10分)已知:①A 是一种分子量为28的气态烃;②2CH3CHO+O2 2CH3COOH
2CH3COOH
现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
回答下列问题 (1)写出A的结构简式_______。
(2)B、D分子中的官能团名称分别是________、__________。
(3)写出下列反应的反应类型:
①____________②____________④____________。
(4)写出下列反应的化学方程式:
①;
④;