对氨水溶液中存在的电离平衡NH3·H2O NH4++OH-,下列叙述正确的是
NH4++OH-,下列叙述正确的是
| A.加水后,溶液中n(OH—)增大 |
| B.加入少量浓盐酸,溶液中n(OH—)增大 |
| C.加入少量浓NaOH溶液,电离平衡向正反应方向移动 |
| D.加入少量NH4Cl固体,溶液中c(NH4+)减少 |
下列说法中正确的是
| A.干冰、液态氯化氢都是电解质 |
| B.Na2O2晶体中既含有离子键又含有共价键 |
| C.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
| D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
化学与生产、生活密切相关。下列说法错误的是
| A.二氧化氮能使织物褪色,对金属材料也有腐蚀作用 |
| B.纯碱是制作面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 |
| C.“水滴石穿”是因为CaCO3与CO2、水发生了化学反应 |
| D.因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 |
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是()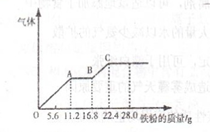
| A.混合酸中NO3-物质的量为2mol•L-1 |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.混合酸中H2SO4的物质的量的浓度为2.5mol |
下列实验能达到相应目的的是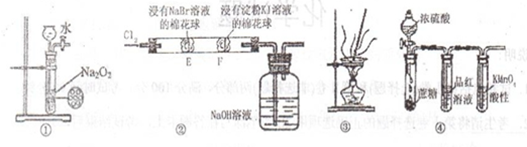
| A.用图①装置制备少量的氧气 |
B.用图②可证明氧化性 |
| C.用图③装置将海带灼烧成灰 |
| D.用图④装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
等质量的下列物质与足浓盐酸反应(必要时可加热),放出Cl2物质的量最多的是
A.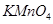 |
B. |
C.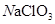 |
D. |