下列实验能达到相应目的的是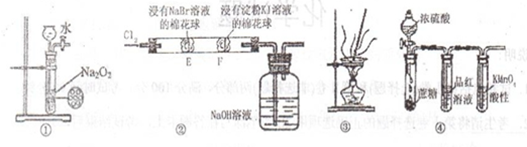
| A.用图①装置制备少量的氧气 |
B.用图②可证明氧化性 |
| C.用图③装置将海带灼烧成灰 |
| D.用图④装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
在可逆反应:2A + 3B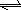 2C,改变下列条件一定能加快反应速率的是( )
2C,改变下列条件一定能加快反应速率的是( )
| A.增大反应物的量 | B.升高温度 |
| C.增大压强 | D.减小生成物的量 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g) ="=" SO2(g)△H1=-297.16 kJ·mol-1
②S(正交,s)+O2(g) ="=" SO2(g)△H2=-296.83 kJ·mol-1
③S(单斜,s) ="=" S(正交,s)△H3
下列说法正确的是( )
| A.△H3=0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s) ="=" S(正交,s) △H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s) ="=" S(正交,s)△H3>0,单斜硫比正交硫稳定 |
已知下列热化学方程式:Zn(s)+1/2O2(l)=ZnO(s)ΔH1 =" -351.1" kJ/mol
Hg(l)+1/2O2(g)=HgO(s)ΔH2 =" -90.7" kJ/mol
由此可知Zn(s)+HgO(s)="ZnO(s)+Hg(l" )△H3,其中△H3的值是( )
| A.-441.8kJ/mol | B.-254.6kJ/mol | C.-438.9kJ/mol | D.-260.4kJ/mol |
分析以下几个热化学方程式,能表示燃烧热的是( )
| A.C(s)+O2(g) ==CO(g)ΔH =" -110.5" kJ/mol |
| B.C(s)+O2(g) ==CO2(g)ΔH =" -393.5" kJ/mol |
| C.2H2(g)+O2(g)==2H2O(l)ΔH =" -571.6" kJ/mol |
| D.H2(g)+1/2O2(g)==H2O(g)ΔH =" -241.8" kJ/mol |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2反应 | D.甲烷在O2中的燃烧反应 |