已知下列热化学方程式:Zn(s)+1/2O2(l)=ZnO(s) ΔH1 =" -351.1" kJ/mol
Hg(l)+1/2O2(g)=HgO(s) ΔH2 =" -90.7" kJ/mol
由此可知Zn(s)+HgO(s)="ZnO(s)+Hg(l" ) △H3,其中△H3的值是( )
| A.-441.8kJ/mol | B.-254.6kJ/mol | C.-438.9kJ/mol | D.-260.4kJ/mol |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH、Fe2+、SO和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO |
| D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH |
下列说法正确的是
| A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 |
| B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| C.乙酸与乙醇的混合液可用分液漏斗进行分离 |
| D.用标准盐酸滴定待测NaOH溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
某钠盐溶液中可能含有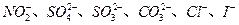 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中含 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
| A.①②④⑤ | B.③④ | C.③④⑤ | D.②③⑤ |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是 |
| B |
向含有少量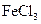 的 的 溶液中加入足量 溶液中加入足量 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去 溶液中少量 溶液中少量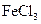 |
| C |
常温下,向饱和 溶液中加少量 溶液中加少量 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下  |
| D |
 与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性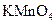 溶液 溶液 |
检验制得气体是否为乙烯 |
下列关于实验原理或操作的叙述中,不正确的是:
| A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4 |
| B.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 |
| C.纸层析实验中,须将滤纸上的试样点浸入展开剂中 |
| D.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |