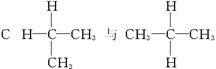某钠盐溶液中可能含有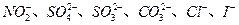 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中含 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
| A.①②④⑤ | B.③④ | C.③④⑤ | D.②③⑤ |
科学家正在研究开发新的能源。“绿色能源”目前是研究的新能源之一,高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到一种“绿色能源”。这种物质是( )
| A.氢气 | B.甲烷 | C.酒精 | D.木炭 |
乳糖是一种双糖,可以水解生成葡萄糖和半乳糖。半乳糖、葡萄糖互为同分异构体,则乳糖的分子式为 ( )
| A.C6H12O6 | B.C18H30O15 | C.C12H24O12 | D.C12O22O11 |
某期刊封面上有如下图所示的一个分子的球棍模型图。图中:“棍”代表单键或双键;不同颜色的球代表不同元素的原子。该模型图可代表一种( )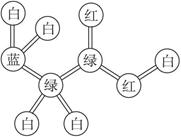
| A.卤代羧酸 | B.酯 | C.氨基酸 | D.醇钠 |
利尿酸在奥运会上被禁用,其结构简式下图所示。下列叙述正确的是()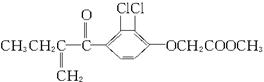
| A.利尿酸衍生物利尿酸甲脂的分子式是C14H14Cl2O4 |
| B.利尿酸分子内处于同一平面的原子不超过10个 |
| C.1 mol利尿酸能与7 mol H2发生加成反应 |
| D.利尿酸能与HCl溶液发生反应生成盐 |
下列各组物质属于同分异构体的是( )
A.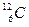 与
与
B.O2与O3