下列实验操作合理或能达到实验目的的是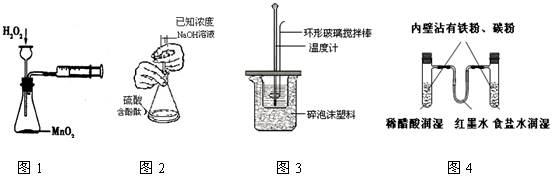
| A.图1:实验目的是定量测定化学反应速率 |
| B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度 |
| C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热 |
| D.图4:模拟铁的腐蚀实验 |
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/(mol·L-1) |
0.1 |
0.2 |
0 |
| 平衡浓度/(mol·L-1) |
0.05 |
0.05 |
0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为1 600
2Z(g),其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)="4" mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)="4" mol·L-1,则此温度下反应①的平衡常数为( )
| A.9 | B.16 | C.20 | D.25 |
高温下,某反应达平衡,平衡常数 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O CO2+H2O CO2+H2O |
电镀废液中Cr2可通过下列反应转化成铬黄(PbCrO4):
Cr2(aq)+2Pb2+(aq)+H2O(l) 2PbCrO4(s)+2H+(aq) ΔH<0
2PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )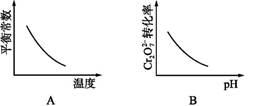

关于平衡常数,下列说法不正确的是( )
| A.平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.平衡常数随温度的改变而改变 |
| C.平衡常数随压强的改变而改变 |
| D.使用催化剂不能使平衡常数增大 |