通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适于电器及其他许多工业使用,必须进行电解精炼。
⑴在精炼铜时,阳极减小的质量与阴极增加的质量是否相等 ▲ (填“是”或“否”);阳极下面沉积金属的成分主要是 ▲ 。
⑵在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐 ▲ ,所以需要定时除去其中的Fe2+、Zn2+。甲同学设计了下列除杂方案I(见下图)。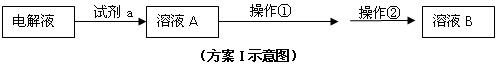
请参照下表给出的数据,回答下列问题:
| 物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
| 开始沉淀时的pH |
7.6 |
5.2 |
2.7 |
8.0 |
| 完全沉淀时的pH |
9.6 |
6.7 |
3.7 |
11.0 |
①试剂a是 ▲ ,其目的是 ▲ 。
②操作①调节pH至b,b的取值范围是 ▲ 。
③调节溶液A的PH时可选择下列哪些试剂 ▲ 。
| A.NaOH | B.CuO | C.Cu(OH)2 | D.NH3·H2O E.Cu2(OH)2CO3 |
④操作②是 ▲ ,方案I中不能够除去的杂质金属阳离子是 ▲ 。
⑶乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的方案I中也应该将溶液pH调至7-8。
你认为乙同学的建议是否正确? ▲ (填“是”或“否”)理由是 ▲ 。
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
(1)B的官能团名称_____________。苯酚与浓溴水反应生成白色沉淀,可用于苯酚的定性检验和定量测定,反应的化学方程式为。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C分子中有3中不同化学环境的氢原子,则M的结构简式为。
(3)生成N的反应的化学方程式,反应类为。
(4)以苯酚为基础原料也可以合成防腐剂F,已知F的相对分子质量为152,其中氧元素的质量分数为31.58%,F完全燃烧只生成CO2和H2O,则F的分子式是;
已知F具有如下结构特征:
①分子结构中含有苯环,能与NaHCO3溶液反应,但不能发生水解反应;
②分子结构中不存在“-O-O-”的连接方式。
符合上述条件的F的同分异构体有种,其中核磁共振氢谱显示其分子中含有4种不同的氢原子的是(写结构简式)
I、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为:.其电极均由石墨材料做成,则电解时不断消耗的电极是;(填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为;
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,则负极的电极反应式为,正极附近溶液的pH(填变大、不变或变小)。
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)图是在一定温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出合成氨的热化学反应方程:(△H的数值用含字母a、b的代数式表示)。
(2)工业合成氨反应如下,
在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ、铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:
有3molFeS2参加反应,转移mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式。
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是、;
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是
,BN中B元素的化合价为;
(3)在BF3分子中,F-B-F的键角是,B原子的杂化轨道类型为
,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是g•cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
某有机物X(C12H13O6Br)的分子中多种官能团,其结构简式为:
(其中Ⅰ、Ⅱ未知部分),已知X可以发生如图所示的转化
已知向X、E的水溶液中滴入FeCl3溶液均发生显色反应,E的核磁共振氢谱图中只有两个峰;G、M都能与NaHCO3溶液反应。
(1)由B转化成D的化学方程式是;
(2)G分子所含官能团名称是;
(3)E的结构简式是;
(4)F与G互为同分异构体,F的分子中只羧基、羟基和醛基三种,且同一个碳原子上不能同时连有两个羟基.则F的分子结构有种
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为,还原产物是。
(2)在上述除杂过程中,通入空气的作用是废渣的主要成分是。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是。